Lý thuyết về Quá trình đẳng áp, phương trình trạng thái, phương trình C-P
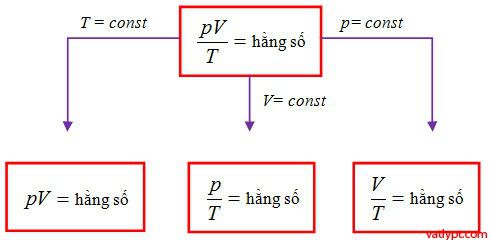
phương trình trạng thái của khí lí tưởng:
\[\dfrac{pV}{T}=\] hằng số
\[\dfrac{p_{1}V_{1}}{T_{1}}=\dfrac{p_{2}V_{2}}{T_{2}}=…=\dfrac{p_{n}V_{n}}{T_{n}}\]
Quá trình biến đổi đẳng áp:
là quá trình biến đổi trạng thái của chất khi khi áp suất không đổi p1=p2=.. =p$_{n}$
→ công thức của quá trình biến đổi đẳng áp từ phương trình trạng thái
\[\dfrac{V}{T}=\] hằng số→ V ∼ T (thể tích tỉ lệ thuận với nhiệt độ)
\[\dfrac{V_{1}}{T_{3}}=\dfrac{V_{2}}{T_{2}}=…=\dfrac{V_{n}}{T_{n}}\]
Phương trình Clapeyron-Mendeleev (Phương trình C-P)
Phương trình Clapeyron-Mendeleev được xây dựng từ phương trình trạng thái của khí lí tưởng áp dụng cho trạng thái của lượng khí xác định ở điều kiện tiêu chuẩn
po = 1,013.105Pa; To = 0oC = 273K; thể tích Vo = n.0,0224 m3/mol
\[\dfrac{p_{o}V_{o}}{T_{o}}= n.\dfrac{1,013.10^{5}.0,0224}{273} = n.8,31\] → R = 8,31
po = 1atm; To = 0oC = 273K; thể tích Vo = n.22,4 lít/mol
\[\dfrac{p_{o}V_{o}}{T_{o}}= n.\dfrac{1.22,4}{273} = n.0,082\] → R = 0,082
Phương trình Clapeyron-Mendeleev
\[\dfrac{pV}{T}=nR=>pV=nRT=\dfrac{m}{M}RT\] (*)
Trong đó
- p: áp suất
- n: số mol
- R = 8,31 hoặc 0,082
- m: khối lượng khí (g)
- M: khối lượng mol phân tử của chất khí (g)
Dạng bài tập phương trình trạng thái khí lí tưởng cơ bản
áp dụng biểu thức phương trình trạng thái của khí lí tưởng để tính các thông số trạng thái
\[\dfrac{p_{1}V_{1}}{T_{1}}=\dfrac{p_{2}V_{2}}{T_{2}}=…=\dfrac{p_{n}V_{n}}{T_{n}}\]
Dạng bài tập phương trình trạng thái của khí lí tưởng có đồ thị
Trong hệ tọa độ (p,V): đường đẳng nhiệt là đường hypebol
Trong hệ tọa độ (V,T): đường đẳng áp là đường thẳng kéo dài đi qua gốc O
Trong hệ tọa độ (p,T): đường đẳng tích là đường thẳng kéo dài đi qua gốc O
Trong các hệ tọa độ còn lại đường đẳng quá trình của một thông số trạng thái là đường vuông góc với trục tọa độ biểu diễn giá trị của thông số trạng thái đó.
Nhìn vào đồ thị, phân tích các quá trình biến đổi sau đó áp dụng các công thức của các định luật liên quan.
Video bài giảng: bài tập phương trình trạng thái của khí lí tưởng
Bài tập phương trình trạng thái của khí lí tưởng
Bài tập 1: Một xilanh chứa khí lí tưởng ở áp suất 0,7atm và nhiệt độ 47oC.
a/ Tính nhiệt độ trong xilanh khi áp suất trong xilanh tăng đến 8atm còn thể tích khí trong xilanh giảm 5lần.
b/ Tính áp suất bên trong xilanh khi giữ pittong cố định tăng nhiệt độ khí trong xilanh lên tới 273oC
Phân tích bài toán
a/ Trạng thái 1: T1=320K; p1=0,7atm; V1;
Trạng thái 2: p2=8atm; V2=V1/5;
b/ Trạng thái 3: T3=546K; V3=V1
Giải
a/ \[\dfrac{p_{1}V_{1}}{T_{1}}=\dfrac{p_{2}V_{2}}{T_{2}}\] => T2=731K
b/ \[\dfrac{p_{1}V_{1}}{T_{1}}=\dfrac{p_{3}V_{3}}{T_{3}}\] => p3=1,19atm
Bài tập 2: Không khí ở áp suất 105Pa, nhiệt độ 0oC có khối lượng riêng 1,29kg/m3. Tính khối lượng riêng của không khí ở áp suất 2.105Pa, nhiệt độ 100oC.
Phân tích bài toán
Trạng thái 1: T1=273K; p1=105Pa; V1=\[\dfrac{m}{\rho_{1} }\]
Trạng thái 2: T2=373K; p2=2.105Pa; V2=\[\dfrac{m}{\rho_{2} }\]
Giải
\[\dfrac{p_{1}V_{1}}{T_{1}}=\dfrac{p_{2}V_{2}}{T_{2}}\] => ρ2=1,89kg/m3.
Bài tập 3: Tính nhiệt độ ban đầu của một khối khí xác định biết rằng khi nhiệt độ tăng thêm 16oC thì thể tích khí giảm đi 10% so với thể tích ban đầu, áp suất thì tăng thêm 20% so với áp suất ban đầu.
Phân tích bài toán
Trạng thái 1: p1; V1; T1
Trạng thái 2: p2=p1 + 0,2p1; V2=V1 – 0,1V1; T2=T1 + 16
Giải
\[\dfrac{p_{1}V_{1}}{T_{1}}=\dfrac{p_{2}V_{2}}{T_{2}}\] =>; T1=200K
Bài tập 4: Một máy nén khí ở áp suất 1atm mỗi lần nén được 4 lít khí ở nhiệt độ 27oC vào trong bình chứa thể tích 2m3 áp suất ban đầu 1atm. Tính áp suất khí bên trong bình chứa sau 1000 lần nén khí biết nhiệt độ trong bình sau 1000 lần nén là 42oC.
Phân tích bài toán
Trạng thái 1: p1=1atm; V1=2m3 + 4.1000 (lít)=6m3; T1=300K
Trạng thái 2: V2=2m3; T2=315K
Giải
\[\dfrac{p_{1}V_{1}}{T_{1}}=\dfrac{p_{2}V_{2}}{T_{2}}\] =>; p2=3,15atm
Bài tập 5: Thể tích của hỗn hợp khí trong xilanh là 2dm3, nhiệt độ là 47oC và áp suất ban đầu là 1atm. Tính nhiệt độ của hỗn hợp khí trong xi lanh khi píttong nén khí trong xi lanh làm thể tích giảm đi 10 lần, áp suất tăng đến 15atm.
Phân tích bài toán
Trạng thái 1: p1=1atm; V1=2dm3; T1=320K
Trạng thái 2: p2=15atm; V2=0,2dm3;
Giải
\[\dfrac{p_{1}V_{1}}{T_{1}}=\dfrac{p_{2}V_{2}}{T_{2}}\] => T2 = 480K
Bài tập 6: Tìm nhiệt độ sau hai quá trình biến đổi trạng thái: nén khí đẳng nhiệt làm thể tích khối khí tăng lên 2 lần; giãn đẳng áp trở về thể tích ban đầu. Vẽ đồ thị các quá trình biến đổi trạng thái trên trong hai hệ tọa độ (p,T) và (p,V)
Phân tích bài toán
Trạng thái 1: T1=300K; V1; p1
Trạng thái 2: nén đẳng nhiệt => T2=T1 = 300K; V2=2V1=> p2=p1/2
Trạng thái 3: dãn đẳng áp => V3=V1; p3=p2=p1/2; T3
Giải
\[\dfrac{p_{1}V_{1}}{T_{1}}=\dfrac{p_{3}V_{3}}{T_{3}}\] => T3=150K
Bài tập 7: Một bình thủy tinh hình trụ tiết diện 100cm2 chứa khí lí tưởng bị chặn với tấm chắn có khối lượng không đáng kể, áp suất, nhiệt độ, chiều cao của cột không khí bên trong bình lần lượt là 76cmHg, 20oC và 60cm. Đặt lên tấm chắn vật có trọng lượng 408N, cột khí bên trong bình có chiều cao 50cm. Tính nhiệt độ của khí bên trong bình.
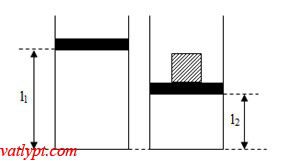
Phân tích bài toán
Trạng thái 1: T1=293K; p1=1,013.105Pa; V1=l1.S
Trạng thái 2: T2; p2=p1 + F/S=1,421.105Pa; V2=l2.S
Giải
\[\dfrac{p_{1}V_{1}}{T_{1}}=\dfrac{p_{2}V_{2}}{T_{2}}\] => T2=342K
Bài tập 8: Bình kín được ngăn làm hai phần bằng nhau (phần A, phần B) bằng tấm cách nhiệt có thể dịch chuyển được. Biết mỗi bên có chiều dài 30cm và nhiệt độ của khí trong bình là 27oC, xác định khoảng dịch chuyển của tấm cách nhiệt khi nung nóng phần A thêm 10oC và làm lạnh phần B đi 10oC.
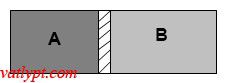
Phân tích bài toán
Gọi h là chiều cao của bình, y chiều rộng của bình, x là khoảng vách ngăn dịch chuyển.
Phần A:
Trạng thái 1: Vo=h.lo.y; po; To=300K
Trạng thái 2: V$_{2A}$=h(lo + x).y; p$_{2A}$; T$_{2A}$=310K
Phần B
Trạng thái 1: Vo=h.lo.y; po; To=300K
Trạng thái 2: V$_{2B}$=h(lo – x).y; p$_{2B}$; T$_{2B}$=290K
Để vách ngăn nằm cân bằng sau khi nung nóng một bên và làm lạnh một bên thì áp suất của phần A và phần B sau khi nung nóng phải bằng nhau => p$_{2A}$=p$_{2B}$
Giải
\[\dfrac{p_{o}V_{o}}{T_{o}}=\dfrac{p_{2A}V_{2A}}{T_{2A}}\] (1)
\[\dfrac{p_{o}V_{o}}{T_{o}}=\dfrac{p_{2B}V_{2B}}{T_{2B}}\] (2)
Từ (1) và (2) lưu ý p$_{2A}$=p$_{2B}$ => x=1cm
Bài tập 9. Khí cầu có dung tích 328m3 được bơm khí hidro. Khi bơm xong, hidro trong khí cầu có nhiệt độ 27oC, áp suất 0,9atm. Hỏi phải bơm bao nhiêu lâu nếu mỗi giây bơm được 2,5g hidro vào khí cầu.
V = 328m3 = 328.103lít; T = 300K; p = 0,9atm, R = 0,082 atm.lít/mol.K, µ = 2g/mol
Gọi m là khối lượng khí đã bơm vào khí cầu.
pV = (m/µ)RT => m = µpV/RT = 24000g
t = m/2,5 = 9600s
Bài tập 10. Trong một ống dẫn khí tiết diện đều s = 5cm2 có khí CO2 chảy qua ở nhiệt độ 35oC và áp suất 3.105N/m2. Tính vận tốc của dòng khí biết trong thời gian 10 phút có m = 3kg khí CO2 qua tiết diện ống.
S = 5.10-4m2; T = 308K; m = 3kg; µ = 44 kg/mol; R = 8,31.10-3kJ/kmol.K, p = 3.105N/m2, t = 600s
thể tích khí qua ống trong thời gian 10 phút: V = v.S.t
pV = (m/µ)RT => v = 1,939 m/s
Bài tập 11. Hai bình hình cầu được nối với nhau bằng một ống khóa, chứa hai chất khí không tác dụng hóa học với nhau, ở cùng một nhiệt độ. Áp suất trong hai bìh là p1 = 2.105N/m2 và p2 = 106N/m2. Mở khóa nhẹ nhàng để hai bình thông với nhau sao cho nhiệt độ không đổi. Khi cân bằng xảy ra, áp suất ở hai bình là p = 4.105N/m2. Tính tỉ số thể tích của hai bình cầu.
Khi chưa mở khóa: bình I: p1; V1; T; bình II: p2; V2; T
Khi mở khóa: bình I: p’1; V1 + V2; T; bình II: p’2; V1 + V2; T
áp dụng định luật Bôilơ-Mariôt:
p1V1 = p’1(V1 + V2) (1)
p2V2 = p’2(V1 + V2) (2)
Theo định luật Đanton: p = p’1 + p’2 (3)
từ (1); (2) và (3) => \[\dfrac{V_1}{V_2}\] = \[\dfrac{p_2-p}{p-p_1}\] = 3
Bài tập 12. Trong một bình kín có hỗn hợp khí mêtan và ôxi ở nhiệt độ phòng và áp suất po = 760mmHg. Áp suất riêng phần của metan là oxi bằng nhau. Sau khi xảy ra sự nổ trong bình kín, người ta làm lạnh để hơi nước ngưng tự và được dẫn ra ngoài. Sau đó người ta đưa bình về nhiệt độ ban đầu. Tính áp suất khí trong bình sau đó.
Phản ứng giữa metan và oxi: CH4 + 2O2 → CO2 + H2O
ban đầu metan và oxi có áp suất riêng phần bằng nhau nên có số mol bằng nhau.
n$_{metan}$ = n$_{oxi}$ = n => số mol hỗn hợp khí ban đầu là n$_{hh}$ = 2n
Sau khi đốt cháy số mol metan còn thừa n’$_{metan }$ = n/2
Số mol CO2 tạo ra n$_{CO2 }$ = n/2 => số mol hỗn hợp khí sau phản ứng
n’$_{hh}$ = n => p = po/2 = 380mmHg
Bài tập 13. Một hỗn hợp không khí gồm 23g Oxi va 76,4g Nitơ. Tính
a/ Khối lượng của 1 mol hỗn hợp.
b/ Thể tích hỗn hợp ở áp suất 750mmHg, nhiệt độ 27oC.
c/ Khối lượng riêng của hỗn hợp ở điều kiện trên.
d/ Áp suất riêng phần của oxi và nitơ ở điều kiện trên.
a/ Gọi µ; µ1; µ2 là khối lượng mol của không khí, oxi và nitơ
phương trình Claperon-Mendeleev
p = (m/µ)RT/V
p1 = (m1/µ1)RT/V1
p2 = (m2/µ2)RT/V2
Theo định luật Đanton: p = p1 + p2
=> µ = \[\dfrac{m}{\dfrac{m_1}{\mu_1}+\dfrac{m_2}{\mu_2}}\] = 29g/mol
b/ Thể tích m (g) không khí ở điều kiện tiêu chuẩn Vo = (m/µ).22,4 lít
thể tích của m(g) không khí ở áp suất p, nhiệt độ T:
V = poT.Vo/(pTo) = 86 lít
c/ Khối lượng riêng của hỗn hợp khí D = m/V = 1,16 g/lít
d/ vì áp suất tỉ lệ với số mol trong hỗn hợp
p1 = p.\[\dfrac{m_1/\mu_1}{m/\mu}\] = 160mmHg
p2 = p – p1 = 590mmHg
Bài tập 14. Một hỗn hợp khí heli và argon ở áp suất p = 152.103N/m2 và nhiệt độ T = 300K, khối lượng riêng ρ = 2kg/m3. Tính mật độ phân tử khí heli và argon trong hỗn hợp. Biết He = 4; Ar = 40
xét V=1m3 hỗn hợp khí => m = ρV = 2kg
gọi m1; m2 là khối lượng của He và Ar trong hỗn hợp
m = m1 + m2 (1)
p = p1 + p2 = (m1/µ1 + m2/µ2)RT/V (2)
từ (1) và (2) => m2 = 1,95125kg; m1 = 0,0488kg
=> mật độ phân tử Ar: n2 = (m2/40).N$_{A}$/V = 0,294.1026/m3
mật độ phân tử He: n1 = (m1/4).N$_{A}$/V = 0,00734.1026/m3
Bài tập 15. Một ống thủy tinh một đầu kín, chứa một lượng khí. Ấn miệng ống thẳng đứng vào chậu thủy ngân, chiều cao ống còn lại là 10cm. Ở 0oC mực thủy ngân trong ống cao hơn trong chậu 5cm. Hỏi phải tăng nhiệt độ lên bao nhiêu để mực thủy ngân trong ống bằng trong chậu. Biết áp suất khí quyển po= 750mmHg. Mực thủy ngân trong chậu dâng lên không đáng kể.
L = 10cm = 100mm; h = 5cm = 50mm
Ban đầu khí trong ống có:
V1 = S(L-h); p1 = po – h; T1 =273K
khi nhiệt độ tăng lên:
V2 = SL; p2 = po, T2
áp dụng phương trình trạng thái của khí lí tưởng
p1V1/T1 = p2V2/T2 => T2 = 585K
Bài tập 16. Một bình dung tích 10lít chứa 2g hidrô ở 27oC. Tính áp suất khí trong bình.
p = (m/µ)RT/V = (2/2)(0,082.300)/10 = 2,46atm
Bài tập 17. Tính thể tích của 10g khí oxi ở áp suất 738 mmHg và nhiệt độ 15oC
V = (m/µ)RT/p = (10/32)(0,082.288)/0,98 = 7,53 lít
Bài tập 18. Một chất khí có khối lượng 1g ở nhiệt độ 27oC dưới áp suất 0,5atm và có thể tích là 1,8lít, hỏi khí đó là khí gì? biết rằng đó là một đơn chất.
pV = (m/µ)RT => µ = 28 => N2
Bài tập 19. Bình dung tích 22 lít chứa 0,5g khí O2. Bình chỉ chịu được áp suất không quá 21atm. Hỏi có thể đưa khí trong bình tới nhiệt độ tối đa bao nhiêu để bình không vỡ.
pmax = (m/µ)RTmax => Tmax = 352K
Bài tập 20. Bình chứa được 4g khí Hidro ở 53oC dưới áp suất 44,4.105 N/m2. Thay Hidro bởi khí khác thì bình chứa được 8g khí mới ở 27oC dưới áp suất 5.105N/m2. Khi thay Hidro là khí gì? biết khí này là đơn chất.
p1/p2 = m1µ2T1/m2µ1T2 = > µ2 = 32 => O2
Bài tập 21. Một lượng khí hidro ở 27oC dưới áp suất 99720 N/m2. Tìm khối lượng riêng của khí.
µ = 2kg/kmol; R = 8,31.103kJ/kmol.K; p = 99720 N/m2
D = m/V = µp/RT = 0,08kg/m3
Bài tập 22. Ở độ cao h không khí có áp suất 230 mmHg nhiệt độ – 43oC. Tìm khối lượng riêng của không khí ở độ cao nói trên. Biết rằng ở mặt đất không khí có áp suất 760mmHg, khối lượng riêng 1,22kg/m3, nhiệt độ 15oC
trên mặt đất D1 = m/V1 = µp1/RT1(1)
ở độ cao h: D2 = m/V2 = mp2/RT2 (2)
từ (1) và (2) => D2 = p2T1D1/(p1T2) = 0,46 kg/m3
Bài tập 23. Trong một ống dẫn khí tiết diện đều S = 5cm2 có khí CO2 chảy qua ở nhiệt độ 35oC và áp suất 3.105N/m2. Tính vận tốc của dòng khí biết trong thời gian 10phút có m = 3kg khí CO2 qua tiết diện ống.

Bài tập 24. Có 10g oxi ở 47oC, áp suất 2,1atm, sau khi đung nóng đẳng áp để thể tích khí là 10lít. Tìm
a/ Thể tích khí trước khi đun
b/ Nhiệt độ sau khi đung.
c/ Khối lượng riêng của khí trước và sau khi đun.

Bài tập 25. Một bình cầu thủy tinh được can 3 lần trong các điều kiện
a/ Đã hút chân không
b/ Chứa đầy không khí ở điều kiện tiêu chuẩn
c/ Chứa đầy một lượng khí nào đó ở áp suất p = 1,5atm.
Khối lượng cân tương ứng trong từng lần cân là m1 = 200g, m2 = 240g, m3 = 210g. Nhiệt độ coi như không đổi. Tính khối lượng mol của khí trong lần cân thứ 3.

Bài tập 26. Một xi lanh đặt thẳng đứng có tiết diện tay đổi như hình vẽ. Giữa hai pittong có n mol không khí. Khối lượng và diện tích tiết diện các pitton được nối với nhau bằng một thanh nhẹ có chiều dài l và cách đều chỗ nối của hai đầu xilanh. Hỏi khi tăng nhiệt độ thêm ΔT thì các pittong dịch chuyển bao nhiêu? cho biết áp suất khí quyển là po.
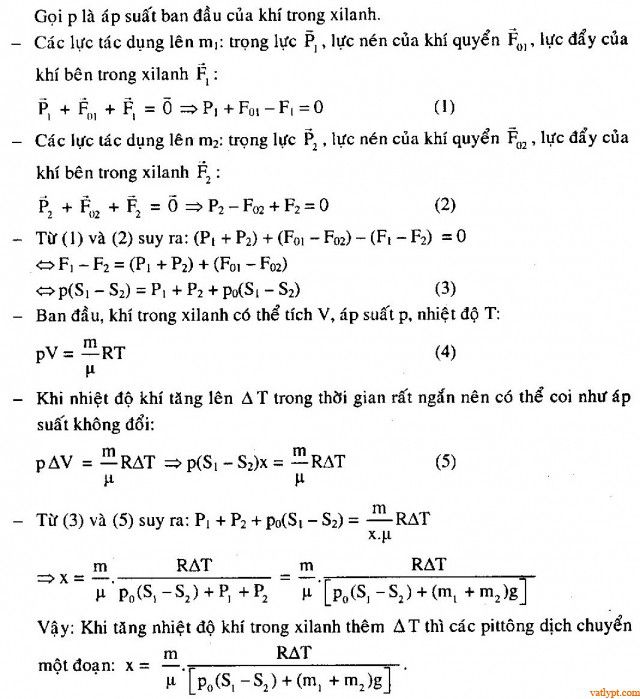
Bài tập 27. Xilanh kính chia làm hai phần, mỗi phần dài 52cm và ngăn cách nhau bằng pittong cách nhiệt. Mỗi phần chứa một lượng khí giống nhau ở 27oC, 750mmHg. Khi nung nóng một phần thêm 50o thì pittong dịch chuyển một đoạn bằng bao nhiêu. Tìm áp suất sau khi nung.

Bài tập 28. Xilanh chia làm hai phần, mỗi phần dài 42cm và ngăn cách nhau bởi một pittong cách nhiệt. Mỗi phần xilanh chứa cùng một khối lượng khí giống nhau, ở 27oC dưới áp suất 1at. Cần phải nung nóng khí ở một phần của xilanh lên bao nhiêu để pittong có thể dịch chuyển 2cm. Tính áp suất của khí sau khi nung.

Bài tập 29. Hai bình chứa cùng một lượng khí nối với nhau bằng một ống nằm ngang tiết diện 0,4cm2. ngăn cách nhau bằng một giọt thủy ngân trong suốt. Ban đầu mỗi phần có nhiệt độ 27oC, thể tích 0,3lít. Tính khoảng dịch chuyển của một giọt thủy ngân khi nhiệt độ bình I tăng thêm 2oC, bình II giảm 2oC. Coi bình dãn nở không đáng kể.

Bài tập 30. Hai bình giống nhau chứa một chất khí nào đó, nối với nhau bằng ông ngang, chính giữa ống có một giọt thủy ngân. Bình I có nhiệt độ T1, bình II có nhiệt độ T2 (T2 > T1). Giọt thủy ngân sẽ di chuyển thế nào nếu
a/ nhiệt độ mỗi bình tăng gấp dôi
b/ nhiệt độ mỗi bình tăng một lượng ΔT như nhau.

Bài tập 31. Một pittong chuyển động không ma sát trong một xilanh kín thẳng đứng. Phía trên và dưới pittong có hai khối lượng bằng nhau của cùng một khí lí tưởng. Toàn thể xilanh có nhiệt độ T. Khi đó tỉ số thể tích của hai khối khí là V1 / V2 = n > 1. Tính tỉ số này khi nhiệt độ xilanh có giá trị T’ < T. Bỏ qua sự giãn nở vì nhiệt của pittong và xilanh

Bài tập 32. Một căn phòng dung tích 30cm3 có nhiệt độ tăng từ 17oC đến 27oC. Tính độ biến thiên khối lượng của không khí trong phòng. Biết áp suất khí quyển là 1,0atm và khối lượng mol không khí là 19g/mol

Bài tập 33. Bình chứa khí nén ở 27oC, áp suất 40atm. Một nửa lượng khí trong bình thoát ra và hạ nhiệt độ xuống đến 12oC. Tìm áp suất của khí còn lại trong bình.

Bài tập 34. Một bình kín, thể tích 0,4m3, chứa khí ở 27oC và 1,5atm. Khi mở nắp, áp suất khi còn 1atm, nhiệt độ 0oC.
a/ tìm thể tích khí thoát ra ở 0oC, 1atm
b/ Tìm khối lượng khí còn lại trong bình và khối lượng khí thoát ra khỏi bình, biết khối lượng riêng của khí ở điều kiện tiêu chuẩn là Do = 1,2kg/m3

Bài tập 35. Một bình chứa m = 0,3kg heli. Sau một thời gian do bị hở, khí heli thoát ra một phần. Nhiệt độ tuyệt đối của khí giảm tới 10%, áp suất giảm 20%. Tính số nguyên tử heli đã thoát ra khỏi bình.
Bài tập 36. Bình dung tích V = 4lít chứa khí có áp suất p1 = 840mmHg, khối lượng tổng cộng của bình và khí là m1 = 546g. Cho một phần khí thoát ra ngoài, áp suất giảm đến p2 = 735mmHg, nhiệt độ như cũ, khối lượng của bình và khí còn lại là m2 = 543g. Tìm khối lượng riêng của khí trước và sau thí nghiệm.
Bài tập 37. Hai bình giống nhau được nối với nhau bằng một ống nhỏ. Trong ống có một van. Van chỉ mở khi độ chênh lệch áp suất hai bên là Δp = 1,1amt. Ban đầu một bình chứa khí lí tưởng ở nhiệt độ t1 = 27oC, áp suất p1 = 1atm. Còn trong bình kia là chân không. Sau đó người ta nung nóng hai bình lên tới nhiệt độ t2 = 107oC. Hãy tính áp suất cúa khí trong mỗi bình lúc này.
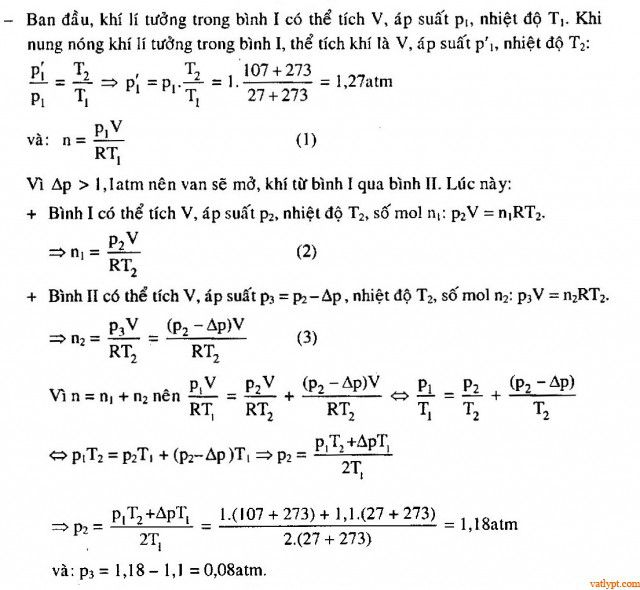
Bài tập 38. Ba bình giống nhau được nối với nhau bằng các ống dẫn mỏng cách nhiệt. Mỗi bình chứa một lượng khí heli nào đó ở cùng nhiệt độ T = 10K. Sau đó bình 1 được làm nóng đến nhiệt độ T1 = 40K, bình II đến T2= 100K, bình III có nhiệt độ không đổi. Hỏi áp suất trong các bình thay đổi bao nhiêu lần.

Bài 39. Hai bình có thể tích V1 = 100cm3, V2 = 200cm3 được nối bằng một ống nhỏ cách nhiệt. Ban đầu hệ có nhiệt độ t = 27oC và chứa Oxi ở áp suất p = 760mmHg. Sau đó bình V1 được giảm nhiệt độ xuống 0oC còn bình V2 tăng nhiệt độ lên đến 100oC. Tính áp suất khí trong các bình.
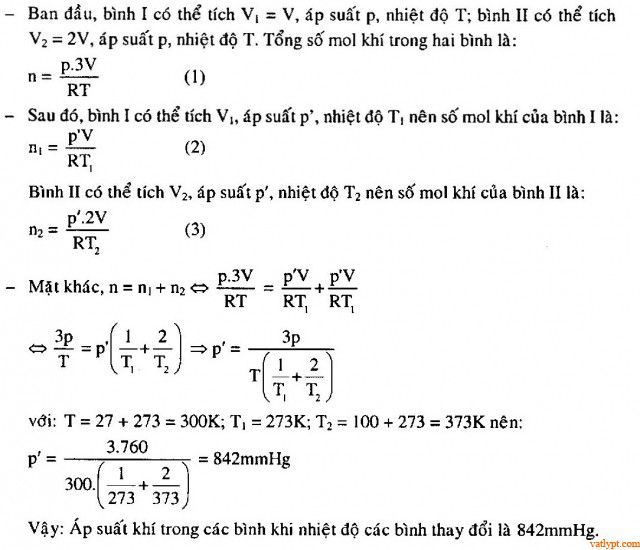
bài tập 26 cần bổ sung hình ảnh.