ĐỒNG PHÂN CỦA AMIN

- Khi viết công thức các đồng phân cấu tạo của amin, cần viết đồng phân mạch C và đồng phân vị trí nhóm chức cho từng loại : amin bậc I, amin bậc II, amin bậc III
- Cách viết đồng phân amin
Bước 1: tính k
Bước 2: viết đồng phân amin bậc I
Bước 3: viết đồng phân amin bậc II
Bước 4: viết đồng phân amin bậc III
Ví dụ viết đồng phân của C4H11N
Bước 1 : tính k
$k = \dfrac{{2.4 + 2 + 1 – 11}}{2} = 0$ → amin no, mạch hở, đơn chức
Bước 2: viết đồng phân amin bậc I
– viết các dạng mạch C có thể có
– ứng với mỗi dạng mạch C, di chuyển nhóm -NH2 đến các nguyên tử C khác nhau (nguyên tắc này giống viết đồng phân ancol)
→ có 4 đồng phân bậc 1
Bước 3: viết đồng phân amin bậc II
– ứng với mỗi dạng mạch C, chèn nhóm -NH- vào liên kết C-C (giống cách viết đồng phân xeton)
Bước 4: viết đồng phân amin bậc III
– ta chia số C ra làm 3 gốc hiđrocacbon (mỗi gốc tối thiểu 1C)
C4H11N có 4C chia làm 3 gốc chỉ có 1 cách chia (1C, 1C và 2C) → có 1 đồng phân amin bậc 3
→ có 1 đồng phân amin bậc III
Vậy C4H11N có 8 đồng phân amin.
TÍNH CHẤT VẬT LÍ
- Metyl-, đimetyl-, trimetyl- và etylamin là những chất khí, mùi khai khó chịu, độc, dễ tan trong nước. Các amin đồng đẳng cao hơn là những chất lỏng hoặc rắn, độ tan trong nước giảm dần theo chiều tăng của phân tử khối.
- Anilin là chất lỏng, sôi ở 184oC, không màu, rất độc, ít tan trong nước, tan trong etanol, benzen. Để lâu trong không khí, anilin chuyển sang màu nâu đen vì bị oxi hóa bởi oxi không khí.
III. Cấu tạo phân tử, so sánh lực bazo của các Amin
1. Cấu trúc phân tử của amoniac và các amin
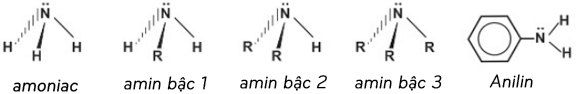
2. So sánh lực bazo giữa các amin
a) Các yếu tố ảnh hưởng đến lực bazơ của amin:
– Mật độ electron trên nguyên tử N: mật độ càng cao, lực bazơ càng mạnh và ngược lại.
– Hiệu ứng không gian: gốc R càng cồng kềnh và càng nhiều gốc R thì làm cho tính bazơ giảm đi, phụ thuộc vào gốc hiđrocacbon.
Ví dụ: Tính bazơ của (CH3)2NH > CH3NH2 > (CH3)3N ; (C2H5)2NH > (C2H5)3N > C2H5NH2
b) Phương pháp so sánh lực bazo giữa các amin
– Gốc đẩy electron làm tăng tính bazơ, gốc hút electron làm giảm tính bazơ.
Ví dụ: p-NO2-C6H4NH2 < C6H5NH2< NH3 < CH3NH2 < C2H5NH2 < C3H7NH2
– Amin có càng nhiều gốc đẩy e thì tính bazơ càng mạnh, amin có càng nhiều gốc hút e thì tính bazơ càng yếu. (Rthơm)3N < (R thơm)2NH < RthơmNH2 < NH3 < Rno NH2 < (Rno)2NH < (Rno)3N
– Nếu nguyên tử N trong phân tử amin gắn với các gốc hút e (gốc không no, gốc thơm) thì tính bazơ của amin yếu hơn so với tính bazơ của NH3. Những amin này không làm xanh quỳ tím.
– Amin có càng nhiều gốc đẩy e thì tính bazơ càng mạnh, amin có càng nhiều gốc hút e thì tính bazơ càng yếu.