Cân bằng hóa học là gì?
Cân bằng hóa học là trạng thái mà cả chất phản ứng và sản phẩm đều có nồng độ không có xu hướng thay đổi theo thời gian, do đó không có sự thay đổi có thể quan sát được về tính chất của hệ thống

1. Một số khái niệm Cân bằng hóa học
– Phản ứng thuận nghịch là phản ứng xảy ra theo 2 chiều thuận và nghịch trong cùng điều kiện.
– Cân bằng hoá học là trạng thái của hệ phản ứng thuận nghịch mà ở đó tốc độ phản ứng thuận bằng tốc độ phản ứng nghịch.
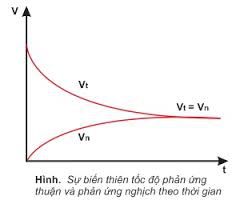
– Cân bằng hoá học là cân bằng động vì tại trạng thái cân bằng, phản ứng thuận và nghịch vẫn tiếp tục xảy ra nhưng với tốc độ bằng nhau nên không làm thay đổi nồng độ của các chất trong hệ phản ứng.
– Biểu thức tính hằng số cân bằng của phản ứng thuận nghịch: nA + mB ↔ pC + qD là:
Kcb =[C]p.[D]q/[A]a.[B]b
Chú ý: hằng số tốc độ của phản ứng cũng như hằng số cân bằng của phản ứng thuận nghịch chỉ phụ thuộc vào yếu tố nhiệt độ.
2. Sự chuyển dịch cân bằng hoá học
Các yếu tố ảnh hưởng cân bằng hóa học gồm: Nồng độ, nhiệt độ, áp suất( chỉ xét những pư có mặt chất khí). Chú ý chất xúc tác không ảnh hưởng tới cân bằng hóa học mà chỉ làm tăng tốc độ phản ứng, làm pư nhanh đạt tới trạng thái cân bằng
Nguyên lý chuyển dịch cân bằng: Cân bằng chuyển dịch theo chiều chống lại các tác động từ bên ngoài.
+>> Nếu tăng nồng độ của chất A thì pư chuyển dịch theo chiều làm giảm nồng đọ chất A và ngược lại
+>> Nếu tăng áp suất của hệ thì cân bằng chuyển dịch theo chiều làm giảm áp suất( Chiều có ít số mol khí hơn) và ngược lại
+>> Nếu tăng nhiệt độ thì pư chuyển dịch theo chiều làm giảm nhiệt độ
Ảnh hưởng của nhiệt độ đến sự dịch chuyển cân bằng
Các hằng số KP, KC, KN đều phụ thuộc vào nhiệt độ nên khi T thay đổi thì các hằng số cân bằng thay đổi theo.
Một hệ đang ở trạng thái cân bằng nếu ta tăng nhiệt độ của hệ thì cân bằng dịch chuyển theo chiều thu nhiệt, khi nhiệt độ của hệ giảm thì cân bằng dịch chuyển theo chiều tỏa nhiệt.
Ví dụ 1: N2(k) + 3H2(k) ⇔ 2NH3(k) ∆Ho = -92,6kJ.
Vì ∆H0 < 0, khi nhiệt độ tăng, cân bằng chuyển dịch theo chiều nghịch (chiều thu nhiệt), nếu nhiệt độ của hệ giảm xuống thì cân bằng chuyển dịch theo chiều thuận (chiều tỏa nhiệt). Như vậy phản ứng tổng hợp amoniac sẽ đạt hiệu suất cao ở nhiệt độ thấp, tuy nhiên ở nhiệt độ thấp tốc độ phản ứng xảy ra chậm. Thực tế cần chấp nhận sự dung hòa giữa hiệu suất nhiệt động lực học với yếu tố động học.
Ví dụ 2: Xét phản ứng nung vôi là phản ứng thu nhiệt
CaCO3(k) ⇔ CaO(r) + CO2(k) có ∆Ho > 0
Nếu tăng nhiệt độ của hệ thì cân bằng dịch chuyển theo chiều thuận (chiều thu nhiệt), ngược lại khi giảm nhiệt độ xuống thì cân bằng dịch chuyển theo chiều nghịch (chiều tỏa nhiệt). Vậy để thu được CaO có hiệu suất cao cần nhiệt độ cao.
Vậy một hệ đang ở trạng thái cân bằng nếu ta thay đổi nhiệt độ của hệ thì cân bằng của phản ứng sẽ dịch chuyển theo chiều của phản ứng nào có tác dụng chống lại sự thay đổi đó.
Ảnh hưởng của áp suất đến sự dịch chuyển cân bằng
Ta có KP = KN. P∆n
Vì KP không phụ thuộc vào P, nên khi thay đổi thì KP = const nên:
– Nếu ∆n > 0: khi tăng P → KN phải giảm (để giữ KP = const) ⇒ chuyển dịch cân bằng theo chiều nghịch (làm giảm số mol khí) và ngược lại.
– Nếu ∆n < 0: khi tăng P → KN phải tăng (để giữ KP = const) ⇒ chuyển dịch cân bằng theo chiều thuận (làm giảm số mol khí) và ngược lại khi giảm P → KN phải giảm cân bằng dịch chuyển theo chiều nghịch (làm tăng số mol khí).
– Nếu ∆n = 0 ⇒ không ảnh hưởng đến sự chuyển dịch cân bằng.
* Nhận xét: kết quả của sự chuyển dịch cân bằng chống lại sự thay đổi bên ngoài:
+ Nếu P tăng ⇒ cân bằng dịch chuyển theo chiều P giảm (giảm số mol khí ∆n < 0).
+ Nếu P giảm ⇒cân bằng dịch chuyển theo chiều P tăng (tăng số mol khí ∆n > 0).
Ví dụ 1:
N2(k) + 3H2(k) ⇔ 2NH3(k)
Có ∆n = 2 – (3 + 1) = -2 < 0 (chiều thuận), chiều nghịch: ∆n > 0.
Nếu tăng áp suất chung của hệ P, cân bằng dịch chuyển theo chiều thuận là chiều làm giảm số mol khí, nghĩa là chiều tạo thành NH3 (hiệu suất phản ứng tăng); nếu ta giảm P thì cân bằng dịch chuyển theo chiều tăng số phân tử khí nghĩa là theo chiều tạo thành N2 và H2 nghĩa là hiệu suất phản ứng giảm. Vì vậy trong công nghiệp, phản ứng tổng hợp NH3 được duy trì ở áp suất 500 – 1000atm và nhiệt độ ở 400 – 500oC.
Ví dụ 2:
CO(k) + H2O(k) ⇔ CO2(k) + H2(k)
Ta có ∆n = (1 + 1) – (1 + 1) = 0 ⇒ P không ảnh hưởng đến sự chuyển dịch cân bằng.
Ảnh hưởng của nồng độ đến sự dịch chuyển cân bằng
Xét phản ứng: aA + bB ⇔ cC + dD
Có KC = const ở T = const
Nếu tăng [A], [B] cân bằng dịch chuyển theo chiều tăng [C], [D] (để giữ KC = const) ⇒ cân bằng dịch chuyển theo chiều thuận làm giảm [A], [B].
Nếu giảm [A], [B] cân bằng dịch chuyển theo chiều giảm [C], [D] (để giữ KC = const) ⇒cân bằng dịch chuyển theo chiều nghịch làm tăng [A], [B].
Tương tự khi tăng nồng độ sản phẩm cân bằng chuyển dịch theo chiều làm giảm nồng độ sản phẩm (chiều nghịch) và làm tăng nồng độ chất tham gia để giữ cho KC=const, hoặc ngược lại.
Vậy khi hệ đang ở trạng thái cân bằng, nếu ta thay đổi nồng độ của một trong các chất thì cân bằng sẽ dịch chuyển theo chiều chống lại sự thay đổi đó.
Ví dụ: C(r) + CO2(k) ⇔ 2CO(k) ở T = const, để giữ cho KC = const
Nếu ta tăng nồng độ chất tham gia CO2, cân bằng chuyển dịch theo chiều thuận làm giảm nồng độ CO2 và tạo ta thêm CO2.
Nếu ta giảm nồng độ chất tham gia CO2, cân bằng chuyển dịch theo chiều nghịch làm tăng nồng độ CO2 và làm giảm bớt CO.
Nếu tăng nồng độ CO, cân bằng dịch chuyển theo chiều nghịch làm giảm nồng độ CO và làm tăng thêm nồng độ CO2 và ngược lại.