Tốc độ phản ứng hóa học là gì?
Tốc độ phản ứng là độ thay đổi nồng độ của một trong các chất tham gia hoặc sản phẩm trong một đơn vị thời gia

1. Khái niệm và biểu thức tính tốc độ phản ứng hóa học
– Tốc độ phản ứng hóa học là đại lượng đặc trưng cho sự nhanh hay chậm của phản ứng và được xác định bằng độ biến thiên nồng độ của chất trong một đơn vị thời gian.
– Các biểu thức tính tốc độ của phản ứng:
- Δv = ΔC/Δt (1)
Trong đó:
- ΔC: độ biến thiên nồng độ của chất (lấy trị tuyệt đối)
- Δt: khoảng thời gian xảy ra sự biến thiên nồng độ.
- Với phản ứng: xA + yB → sản phẩm thì:
v = k.[A]x.[B]y (2)
2. Các yếu tố có ảnh hưởng đến tốc độ của phản ứng hóa học
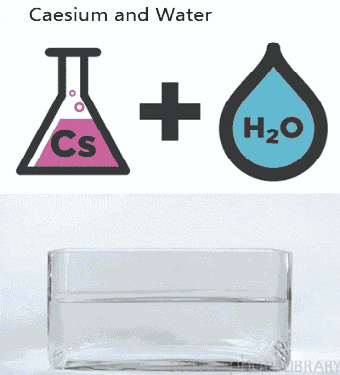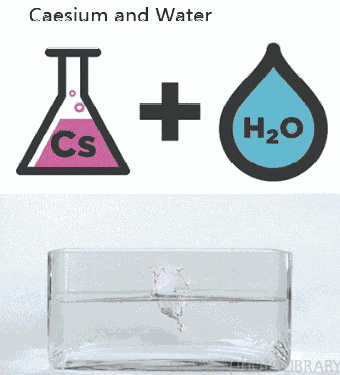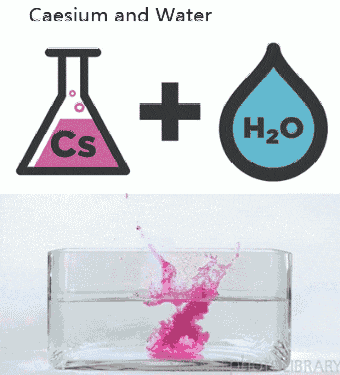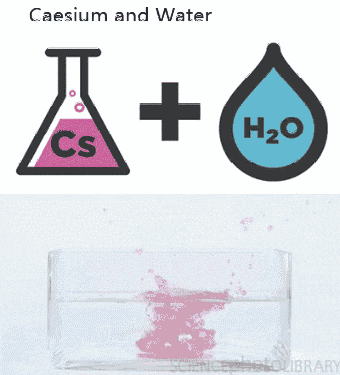
a. Nhiệt độ
– Nhiệt độ tăng thì tốc độ phản ứng tăng và ngược lại vì khi tăng nhiệt độ, tốc độ chuyển động nhiệt của các phân tử tăng → các phân tử va chạm với nhau nhiều hơn và mạnh hơn → phản ứng xảy ra nhanh hơn. Thông thường khi nhiệt độ tăng lên 100C thì tốc độ phản ứng tăng từ 2 đến 4 lần.
– Nếu tăng nhiệt độ phản ứng lên t0C thì tốc độ phản ứng tăng αt/10 (với α là hệ số nhiệt độ – số lần tăng tốc độ khi nhiệt độ tăng lên 100C).
b. Nồng độ các chất tham gia phản ứng
Nồng độ chất tham gia phản ứng tăng thì tốc độ phản ứng tăng (điều này được thấy rõ theo biểu thức (2) vì khi nồng độ chất tham gia phản ứng tăng thì va chạm giữa các phân tử chất tăng → va chạm hiệu quả tăng.
c. Áp suất
– Áp suất chỉ ảnh hưởng đến tốc độ phản ứng có mặt của chất khí.
– Nếu áp suất tăng (nồng độ chất tham gia phản ứng tăng) thì tốc độ phản ứng tăng.
d. Diện tích tiếp xúc bề mặt
– Diện tích tiếp xúc bề mặt tăng thì tốc độ phản ứng tăng
– Diện tích tiếp xúc tỷ lệ nghịch với kích thước của chất rắn.
e. Xúc tác
Chất xúc tác làm tăng tốc độ của phản ứng. Chất kìm hãm làm giảm tốc độ phản ứng.
Ngoài các yếu tố trên thì có nhiều yếu tố khác cũng ảnh hưởng đến tốc độ phản ứng như: môi trường thực hiện phản ứng; tốc độ khuấy trộn…