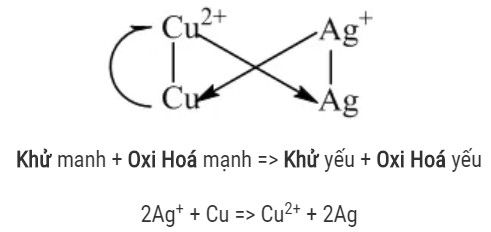
Dãy điện hoá của kim loại cho phép dự đoán chiều của phản ứng giữa 2 cặp oxi hoá – khử theo quy tắc anpha: Phản ứng giữa 2 cặp oxi hoá – khử sẽ xảy ra theo chiều chất oxi hoá mạnh hơn sẽ oxi hoá chất khử mạnh hơn, sinh ra chất oxi hoá yêu hơn và chất khử yếu hơn.

Ý nghĩa của dãy điện hoá của kim loại
Dãy điện hoá của kim loại cho phép dự đoán chiều của phản ứng giữa 2 cặp oxi hoá – khử theo quy tắc anpha: Phản ứng giữa 2 cặp oxi hoá – khử sẽ xảy ra theo chiều chất oxi hoá mạnh hơn sẽ oxi hoá chất khử mạnh hơn, sinh ra chất oxi hoá yêu hơn và chất khử yếu hơn.

Quay tắc alpha của dãy điện hoá của kim loại
Quy tắc alpha (α): Kim loại của cặp oxi hóa — khử đứng trước trong dãy điện hóa đẩy được ion kim loại của cặp oxi hóa – khử đứng sau ra khỏi dung dịch muối. Nói cách khác, cation kim loại trong cặp oxi hóa – khử đứng sau có thể oxi hoá được kim loại trong cặp đứng trước (trừ những kim loại tác dụng với nước).
Mẹo ghi nhớ dãy điện hóa của kim loại
K Na Ba Ca Mg Al Zn Khi Nào Bà Con May Áo Dài
Fe Ni Sn Pb H Phái Người Sang Phố Hỏi
Cu Hg Ag Pt Au Cửa Hiệu Á Phi Âu.
Hoặc chúng ta cũng có thể sử dụng mẹo học thuộc dãy điện hóa khác
Lúc khác Ba Cần Nên Mang Áo Giáp Có Sắt2/Sắt Nên sang Phố Sắt3/Sắt Hỏi cửa Hàng Sắt3/Sắt2 Hiệu Á Phi Âu
li−K−Ba−Ca−Na−Mg−Al−Zn−Cr−Fe2+/Fe−Ni−Sn−Pb−Fe3+/Fe−H−Cu−Hg− Fe3+/ Fe2+−Hg−Ag−Pt−Au
Cần ghi nhớ vị trí của các nguyên tố này để tránh nhầm lẫn: Al, Ag, Pb, Pt
– Áo lụa (Al) trước, Áo gấm (Ag) sau
– Phở bò (Pb) trước, Phở tái (Pt) sau
Các kim loại đứng trước sẽ có tính khử mạnh hơn kim loại đứng sau, cation đứng sau sẽ có tính oxi hóa mạnh hơn cation đứng trước.
Hay đơn giản hơn bạn chỉ cần nhớ rõ nguyên tắc chất oxi hoá mạnh+chất khử mạnh –> chất oxi hoá yếu +chất khử yếu
VD: Cu2+ + Fe Fe2+ + Cu
Ghi nhớ mẹo học thuộc dãy điện hóa này để nó trở thành “bí kíp” tuyệt vời cho bạn trổ tài hóa học của mình.