II – TÍNH CHẤT HOÁ HỌC CỦA ANKEN

Liên kết $\pi$ ở nối đôi của anken kém bền vững, nên trong phản ứng dễ bị đứt ra để tạo thành kiên kết $\sigma$ với các nguyên tử khác. Vì thế, liên kết đôi $C=C$ là trung tâm phản ứng gây ra những phản ứng hoá học đặc trưng cho anken như phản ứng cộng, phản ứng trùng hợp và phản ứng oxi hoá.
1. Phản ứng cộng hiđro (phản ứng hiđro hoá)
Khi có mặt chất xúc tác như $Ni, Pt, Pd$, ở nhiệt độ thích hợp, anken cộng hiđro vào nối đôi tạo thành ankan tương ứng, phản ứng toả nhiệt, thí dụ:
$$CH_2 =CH_2 +H_2 \xrightarrow[{}]{{xt, t^0}} CH_3 -CH_3 $$
$$R^1R^2C=CR^3R^4 +H_2 \xrightarrow[{}]{{xt, t^0}} R^1R^2CH-CHR^3R^4 $$
2. Phản ứng cộng halogen (phản ứng halogen hoá)
a) Cộng clo
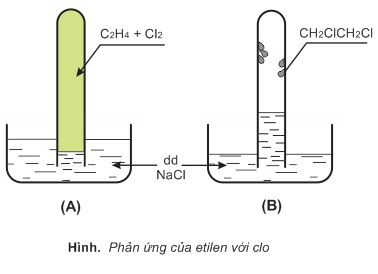
Etilen và clo đều ít tan trong dung dịch natri clorua. Thoạt đầu mức nước trong ống nghiệm thấp (A). Etilen cộng với clo tạo thành chất lỏng dạng dầu, không tan trong nước, bám vào thành ống nghiệm, áp suất trong ống nghiệm giảm làm cho mức nước nâng lên (B).
$$CH_2=CH_2+Cl_2 \rightarrow ClCH_2-CH_2Cl (1,2-đicloetan, t_s:83,5^0C)$$
b) Cộng brom
Cho $0,2 ml$ anken lỏng, chẳng hạn $hex-2-en$, vào ống nghiệm chứa $2 ml$ nước brom, lắc kĩ rồi để yên, màu vàng – da cam của nước brom bị mất.
Brom dễ cộng vào nối đôi của anken tạo thành dẫn xuất đihalogen không màu:
$CH_3CH=CHCH_2CH_2CH_3+Br_2 \rightarrow CH_3CHBr-CHBrCH_2CH_2CH_3 $
($2,3$ – đibromhexan)
Anken làm mất màu của nước brom, vì thế người ta thường dùng nước brom hoặc dung dịch brom trong $CCl_4$ làm thuốc thử để nhận biết anken.
3. Phản ứng cộng axit và cộng nước
a) Cộng axit
Hiđro halogenua ($HCl, HBr, HI$), axit sunfuric đậm đặc, … có thể cộng vào anken.
Thí dụ: $CH_2=CH_2+H-Cl (khí) \rightarrow CH_3CH_2Cl $ (etyl clorua)
$CH_2=CH_2+H-OSO_3H \rightarrow CH_3CH_2OSO_3H$ (etyl hiđrosunfat)
Cơ chế phản ứng cộng axit vào anken
Axit cộng vào anken theo sơ đồ chung:
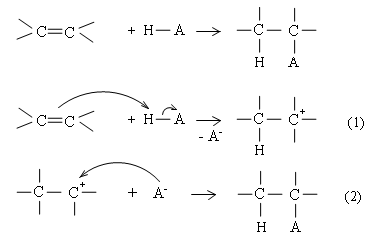
Phản ứng xảy ra qua 2 giai đoạn liên tiếp:
Phản ứng $H-A$ bị phân cắt dị li: $H^+$ tương tác với liên kết $\pi$ tạo thành cacbocation, còn $A^-$ tách ra.
Cacbocation là tiểu phân trung gian không bền, kết hợp ngay với anion $A^-$ tạo sản phẩm.
b) Cộng nước (phản ứng hiđrat hoá)
Ở nhiệt độ thích hợp và có xúc tác axit, anken có thể cộng nước, thí dụ:
$CH_2=CH_2 + H – OH \xrightarrow[{}]{{H^+, t^0}} HCH_2 – CH_2OH $ (etanol)
c) Hướng của phản ứng cộng axit và nước vào anken
Phản ứng cộng axit hoặc nước vào anken không đối xứng thường tạo ra hỗn hợp hai đồng phân, trong đó có một đồng phân là sản phẩm chính. Thí dụ
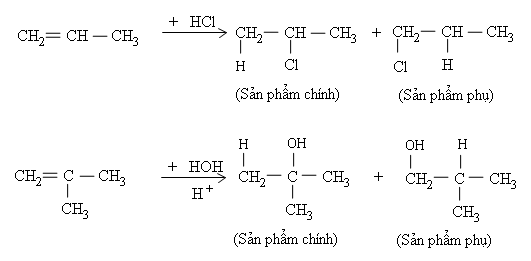
Quy tắc Mac-côp-nhi-côp:
Trong phản ứng cộng axit hoặc nước (kí hiệu chung là $HA$) vào liên kết $C=C$ của anken, $H$ (phần tử mang điện tích dương) ưu tiên cộng vào $C$ mang nhiều $H$ hơn (cacbon bậc thấp hơn), còn $A$ (phần tử mang điện tích âm) ưu tiên cộng vào $C$ mang ít $H$ hơn (cacbon bậc cao hơn).
$4$. Phản ứng trùng hợp
Các anken ở đầu dãy như etilen, propilen, butilen trong những điều kiện nhiệt độ, áp suất, xúc tác thích hợp thì tham gia phản ứng cộng nhiều phân tử với nhau thành những phân tử mạch rất dài và có khối lượng phân tử lớn. Người ta gọi đó là phản ứng trùng hợp. Thí dụ:
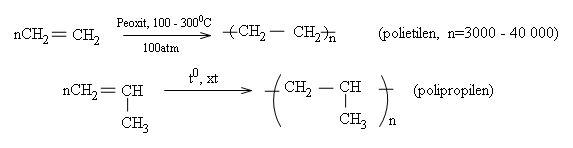
Phản ứng trùng hợp là quá trình kết hợp liên tiếp nhiều phân tử nhỏ giống nhau hoặc tương tự nhau thành những phân tử rất lớn gọi là polime.
Trong phản ứng trùng hợp, chất đầu (các phân tử nhỏ) được gọi là monome. Sản phẩm của phản ứng gồm nhiều mắc xích monome hợp thành nên được gọi là polime. Số lượng mắc xích monome trong một phân tử polime gọi là hệ số trùng hợp và kí hiệu là $n$.
$5$. Phản ứng oxi hoá
Giống với ankan, anken cháy hoàn toàn tạo ra $CO_2, H_2O$ và toả nhiều nhiệt:
$$C_nH_{2n}+\dfrac{3n}{2}O_2 \rightarrow nCO_2 + nH_2O ; \Delta H < 0 $$
Khác với ankan, anken làm mất màu dung dịch $KMnO_4$:
$3CH_2=CH_2 + 2KMnO_4+4H_2O \rightarrow 3HOCH_2-CH_2OH + 2MnO_2+2KOH$
(etylen glicol)
Phản ứng làm mất màu tím của dung dịch kali penmanganat được dùng để nhận ra sự có mặt của liên kết đôi anken.