Nhôm: kí hiệu hóa học Aℓ Nhôm là nguyên tố phủ khắp trang bị 3 (sau ôxy và silic), và là kim chiếc tràn khắp nhất trong vỏ Trái Đất

I. Vị trí của Nhôm AL trong bảng HTTH
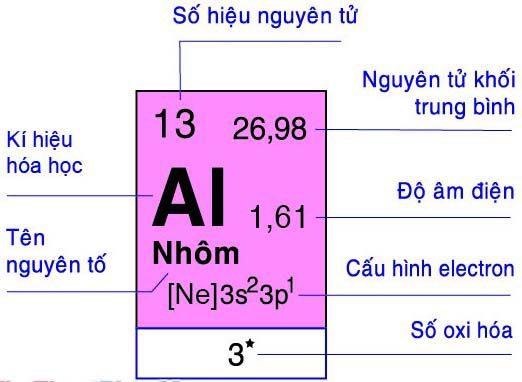
– Cấu hình e nguyên tử: 13Al: 1s22s22p63s23p1
– Vị trí: Al thuộc ô 13, chu kì 3, nhóm IIIA.
II. Trạng thái tự nhiên và tính chất vật lí của Nhôm
1. Trạng thái tự nhiên của nhôm
– Nhôm là kim loại phổ biến nhất trong vỏ quả đất. Trong tự nhiên, Al có trong:
- Đất sét: Al2O3.2SiO2.2H2O.
- Mica: K2O.Al2O3.6SiO2.2H2O.
- Boxit: Al2O3.nH2O.
- Criolit: 3NaF.AlF3 hay (Na3AlF6).
2. Tính chất vật lí của nhôm

– Mạng lập phương tâm diện, dẫn điện tốt (gấp 3 lần sắt, bằng 2/3 lần đồng), dẫn nhiệt tốt (gấp 3 lần sắt); t0nc = 6600C .
– Màu trắng bạc, khá bền và dai, dễ kéo sợi và dát mỏng, nhẹ (D = 2,7 g/cm3).
– Một số hợp kim của nhôm:
- Đuyra (95% Al; 4% Cu; 1% Mg, Mn, Si): nhẹ bằng 1/3 thép, cứng gần bằng thép.
- Silumin (gần 90% Al; 10% Si): nhẹ, bền.
- Almelec (98,5% Al; còn lại là Mg, Si và Fe) dùng làm dây cáp.
- Hợp kim electron (10,5% Al; 83,3% Mg còn lại là Zn, Mn…): chỉ nặng bằng 65% Al lại bền hơn thép, chịu được sự thay đổi đột ngột của nhiệt độ trong một giới hạn lớn nên được dùng làm vỏ tên lửa.
Tính chất hóa học của kim loại nhôm
IV. Điều chế Nhôm
1. Nguyên liệu
Quặng boxit Al2O3 có lẫn SiO2 và Fe2O3.
2. Các giai đoạn điều chế nhôm
– Làm sạch nguyên liệu:
2NaOH + Al2O3 → 2NaAlO2 + H2O
2NaOH + SiO2 → Na2SiO3 + H2O
NaAlO2 + CO2 + 2H2O → NaHCO3 + Al(OH)3
NaOH + CO2 → NaHCO3
2Al(OH)3 → Al2O3 + 3H2O
– Điện phân nóng chảy Al2O3 có mặt criolit Na3AlF6 (hạ nhiệt độ nóng chảy của Al2O3từ 20500C xuống 9000C; tăng độ dẫn điện do tạo thành nhiều ion hơn; tạo lớp bảo vệ không cho O2 phản ứng với Al nóng chảy):
2Al2O3 → 4Al + 3O2↑
V. Hợp chất của Nhôm

1. Nhôm Oxit Al2O3
– Chất rắn màu trắng, không tan và không tác dụng với nước, rất bền vững, nóng chảy ở 20500C.
– Tồn tại ở dạng khan (emeri, corindon, rubi (lẫn Cr2O3), saphia (lẫn TiO2 và Fe3O4) hoặc dạng ngậm nước (boxit).
a) Tính chất hóa học của nhôm oxit
– Tính bền: Al2O3 không bị khử bởi H2, CO ở nhiệt độ cao; Al2O3 tác dụng với C không cho Al kim loại mà tạo Al4C3:
Al2O3 + 9C → Al4C3 + 6CO (> 20000C)
– Nhôm là kim loại lưỡng tính:
+ Al2O3 là oxit bazơ khi tác dụng với axit mạnh → muối + H2O.
Al2O3 + 6HCl → 2AlCl3 + 3H2O
+ Al2O3 là oxit axit khi tác dụng với dung dịch bazơ mạnh → muối + H2O.
Al2O3 + 2NaOH → NaAlO2 + H2O
hay: Al2O3 + 2NaOH + 3H2O → 2Na[Al(OH)4]
Al2O3 + 2OH– → 2AlO2– + H2O
b) Điều chế nhôm oxit
– Nhiệt phân Al(OH)3:
2Al(OH)3 → Al2O3 + 3H2O
2. Nhôm hiđroxit Al(OH)3
– Nhôm hiđroxit Al(OH)3 là chất kết tủa keo, màu trắng.
a) Tính chất hóa học của nhôm hidroxit
– Kém bền với nhiệt:
2Al(OH)3 → Al2O3 + 3H2O (t0)
– Là hiđroxit lưỡng tính:
+ Tác dụng với axit mạnh:
Al(OH)3 + 3HCl → AlCl3 + 3H2O
+ Tác dụng với dung dịch kiềm mạnh:
Al(OH)3 + KOH → KAlO2 + 2H2O
Al(OH)3 + KOH → K[Al(OH)4]
b) Điều chế nhôm hidroxit
– Kết tủa Al3+:
Al3+ + 3OH– (vừa đủ) → Al(OH)3↓
Al3+ + 3NH3 + 3H2O → Al(OH)3↓ + 3NH4+
– Kết tủa AlO2–:
AlO2– + CO2 + 2H2O → Al(OH)3↓ + HCO3–
AlO2– + H+ (vừa đủ) + H2O → Al(OH)3↓
3. Muối nhôm – Nhôm Sunfat Al2(SO4)3
– Muối nhôm hay gặp: phèn chua: K2SO4.Al2(SO4)3.24H2O hay KAl(SO4)2.12H2O
– Các dung dịch AlCl3, Al2(SO4)3 và Al(NO3)3 đều là các axit theo Bronstet có môi trường axit:
AlCl3 → Al3+ + 3Cl–
Al3+ + 3H2O ↔ Al(OH)3 + 3H+
⇒ Giải thích được sự thủy phân của muối Al trong các dung dịch có tính bazơ:
2AlCl3 + 3Na2CO3 + 3H2O → 2Al(OH)3 + 6NaCl + 3CO2
– Phản ứng với dung dịch kiềm: (chú ý cách thức và tỷ lệ phản ứng)
Al3+ + 3OH– → Al(OH)3
Al3+ + 4OH– → [Al(OH)4] –
Al(OH)3 + 3OH– → [Al(OH)4] –
– Các muối aluminat NaAlO2, KAlO2, Ba(AlO2)2 và Ca(AlO2)2 đều là bazơ dung dịch có môi trường bazơ.
AlO2– + 3H2O ↔ Al(OH)3↓ + 3OH–
AlO2– + H+ + H2O → Al(OH)3↓
Al(OH)3 + 3H+ → Al3+ + 3H2O