Hợp chất của nhôm: Nhôm Oxit Al2O3; Nhôm hiđroxit Al(OH)3; Nhôm Sunfat Al2(SO4)3

1. Hợp chất của nhôm: Nhôm Oxit Al2O3

– Chất rắn màu trắng, không tan và không tác dụng với nước, rất bền vững, nóng chảy ở 20500C.
– Tồn tại ở dạng khan (emeri, corindon, rubi (lẫn Cr2O3), saphia (lẫn TiO2 và Fe3O4) hoặc dạng ngậm nước (boxit).
a) Tính chất hóa học của nhôm oxit
– Tính bền: Al2O3 không bị khử bởi H2, CO ở nhiệt độ cao; Al2O3 tác dụng với C không cho Al kim loại mà tạo Al4C3:
Al2O3 + 9C → Al4C3 + 6CO (> 20000C)
– Nhôm là kim loại lưỡng tính:
+ Al2O3 là oxit bazơ khi tác dụng với axit mạnh → muối + H2O.
Al2O3 + 6HCl → 2AlCl3 + 3H2O
+ Al2O3 là oxit axit khi tác dụng với dung dịch bazơ mạnh → muối + H2O.
Al2O3 + 2NaOH → NaAlO2 + H2O
hay: Al2O3 + 2NaOH + 3H2O → 2Na[Al(OH)4]
Al2O3 + 2OH– → 2AlO2– + H2O
b) Điều chế nhôm oxit
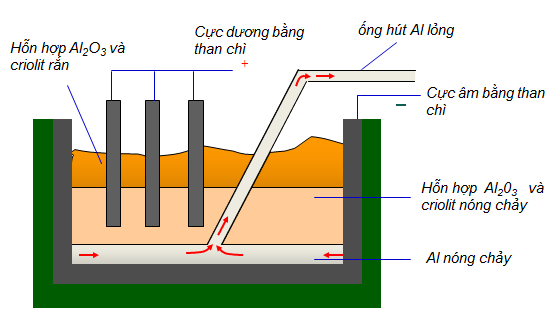
– Nhiệt phân Al(OH)3:
2Al(OH)3 → Al2O3 + 3H2O
2. Hợp chất của nhôm: Nhôm hiđroxit Al(OH)3
– Nhôm hiđroxit Al(OH)3 là chất kết tủa keo, màu trắng.
a) Tính chất hóa học của nhôm hidroxit
– Kém bền với nhiệt:
2Al(OH)3 → Al2O3 + 3H2O (t0)
– Là hiđroxit lưỡng tính:
+ Tác dụng với axit mạnh:
Al(OH)3 + 3HCl → AlCl3 + 3H2O
+ Tác dụng với dung dịch kiềm mạnh:
Al(OH)3 + KOH → KAlO2 + 2H2O
Al(OH)3 + KOH → K[Al(OH)4]
b) Điều chế nhôm hidroxit
– Kết tủa Al3+:
Al3+ + 3OH– (vừa đủ) → Al(OH)3↓
Al3+ + 3NH3 + 3H2O → Al(OH)3↓ + 3NH4+
– Kết tủa AlO2–:
AlO2– + CO2 + 2H2O → Al(OH)3↓ + HCO3–
AlO2– + H+ (vừa đủ) + H2O → Al(OH)3↓
3. Hợp chất của nhôm: Muối nhôm – Nhôm Sunfat Al2(SO4)3

– Muối nhôm hay gặp: phèn chua: K2SO4.Al2(SO4)3.24H2O hay KAl(SO4)2.12H2O
– Các dung dịch AlCl3, Al2(SO4)3 và Al(NO3)3 đều là các axit theo Bronstet có môi trường axit:
AlCl3 → Al3+ + 3Cl–
Al3+ + 3H2O ↔ Al(OH)3 + 3H+
⇒ Giải thích được sự thủy phân của muối Al trong các dung dịch có tính bazơ:
2AlCl3 + 3Na2CO3 + 3H2O → 2Al(OH)3 + 6NaCl + 3CO2
– Phản ứng với dung dịch kiềm: (chú ý cách thức và tỷ lệ phản ứng)
Al3+ + 3OH– → Al(OH)3
Al3+ + 4OH– → [Al(OH)4] –
Al(OH)3 + 3OH– → [Al(OH)4] –
– Các muối aluminat NaAlO2, KAlO2, Ba(AlO2)2 và Ca(AlO2)2 đều là bazơ dung dịch có môi trường bazơ.
AlO2– + 3H2O ↔ Al(OH)3↓ + 3OH–
AlO2– + H+ + H2O → Al(OH)3↓
Al(OH)3 + 3H+ → Al3+ + 3H2O