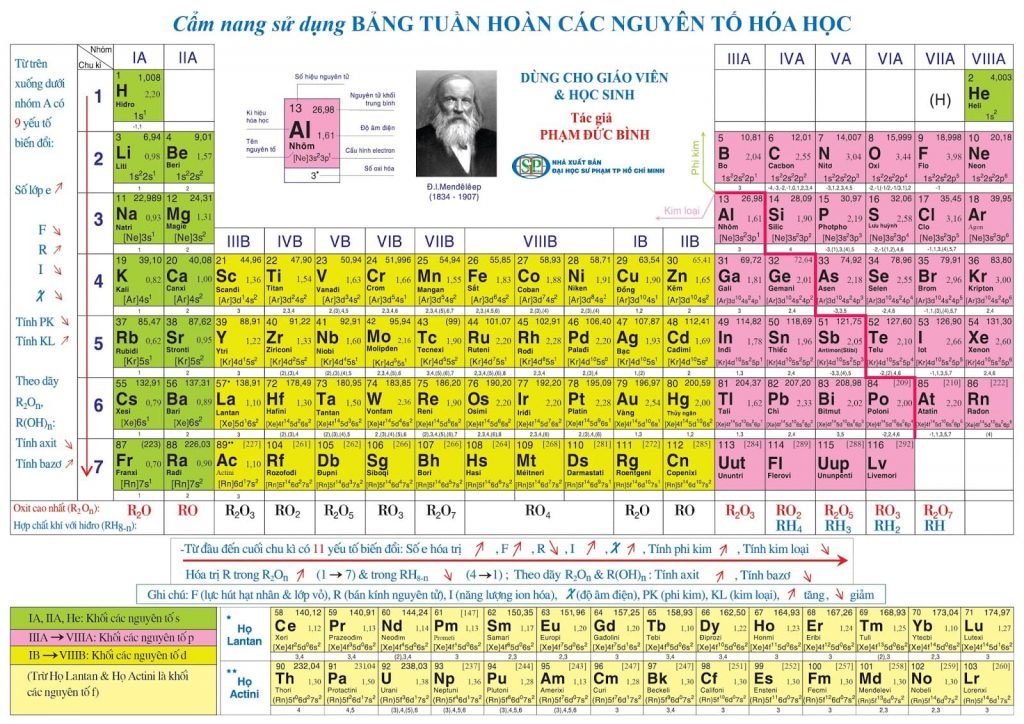
Trong nghiên cứu, giảng dạy và học tập môn hóa học, bảng tuần hoàn là công cụ vô cùng quan trọng và hữu ích.

Nguyên tắc sắp xếp các nguyên tố trong bảng tuần hoàn
– Theo chiều tăng dần của điện tích hạt nhân.
– Cùng số lớp e xếp vào cùng một hàng (chu kì).
– Cùng số e hóa trị được xếp vào cùng một cột (nhóm).
Khối nguyên tố
– Các nguyên tố trong bảng tuần hoàn thuộc 4 khối: khối s, khối p, khối d và khối f.
– e cuối cùng điền vào phân lớp nào (theo thứ tự mức năng lượng) thì nguyên tố thuộc khối đó.
Cấu tạo bảng tuần hoàn
a. Ô nguyên tố
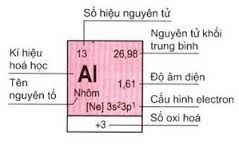
Ô nguyên tố
– Mỗi nguyên tố hóa học chiếm một ô trong bảng tuần hoàn được gọi là ô nguyên tố.
– Số thứ tự ô nguyên tố = số hiệu nguyên tử của nguyên tố (= số e = số p = số đơn vị điện tích hạt nhân).
b. Chu kì
– Chu kì là dãy các nguyên tố mà nguyên tử của chúng có cùng số lớp e, được xếp theo chiều tăng dần của điện tích hạt nhân.
– Số thứ tự chu kì = số lớp e.
– Bảng tuần hoàn hiện có 7 chu kì được đánh số từ 1 đến 7:
+ Chu kì 1, 2, 3: chu kì nhỏ.
+ Chu kì 4, 5, 6, 7: chu kì lớn (chu kì 7 chưa hoàn thành).
c. Nhóm nguyên tố
– Nhóm nguyên tố là tập hợp các nguyên tố mà nguyên tử có cấu hình e tương tự nhau do đó có tính chất hóa học gần giống nhau và được xếp thành 1 cột.
– Có 2 loại nhóm nguyên tố là nhóm A và nhóm B:
+ Nhóm A: bao gồm các nguyên tố s và p.
+ Nhóm B: bao gồm các nguyên tố d và f.
– Số thứ tự nhóm nguyên tố:
+ Số thứ tự nhóm A = tổng số e lớp ngoài cùng.
+ Nhóm B: Xét nguyên tố có cấu hình e nguyên tử kết thúc dạng (n – 1)dxnsy:
* Nếu (x + y) = 3 → 7 thì nguyên tố thuộc nhóm (x + y)B.
* Nếu (x + y) = 8 → 10 thì nguyên tố thuộc nhóm VIIIB.
* Nếu (x + y) > 10 thì nguyên tố thuộc nhóm (x + y – 10)B.
So sánh tính chất của các nguyên tố trong bảng tuần hoàn
Một số tính chất của các nguyên tố trong bảng tuần hoàn biến đổi có quy luật theo chu kì và theo nhóm. Vì vậy dựa vào vị trí của các nguyên tố trong bảng tuần hoàn, có thể so sánh được tính chất của các nguyên tố đó:
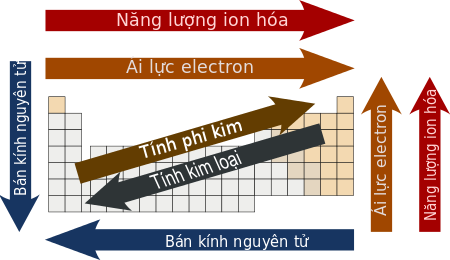
Sự biến đổi tính chất của các nguyên tố theo chu kì và nhóm
Cụ thể là:
| Tính chất | Bán kính nguyên tử | Độ âm điện | Tính kim loại | Tính phi kim | Tính bazơ của oxit, hidroxit | Tính axit của oxit, hidroxit | Số e lớp ngoài cùng |
| Theo chu kì | ↓ | ↑ | ↓ | ↑ | ↓ | ↑ | ↑ từ 1 đến 8 |
| Theo nhóm A | ↑ | ↓ | ↑ | ↓ | ↑ | ↓ | = STT nhóm |
Chú ý:
– Chỉ so sánh được tính chất của 2 nguyên tố thuộc cùng chu kì hoặc cùng nhóm A.
– Nếu các nguyên tố cần so sánh không có cùng mối liên hệ về chu kì hoặc nhóm thì khi cần phải chọn nguyên tố trung gian rồi đưa về cùng hàng, cột để so sánh hoặc loại trừ.
Mối quan hệ giữa các nguyên tố trong bảng tuần hoàn
Vị trí của các nguyên tố trong bảng tuần hoàn có mối quan hệ với nhau.
Cụ thể là:
– Nếu 2 nguyên tố A và B ở cùng 1 chu kì và ở 2 nhóm A liên tiếp thì:
- |ZA – ZB| = 1 nếu nguyên tố thuộc chu kì nhỏ
- |ZA – ZB| = 11 nếu nguyên tố thuộc chu kì lớn và ở nhóm IIA và IIIA
– Nếu 2 nguyên tố thuộc cùng một nhóm A và ở 2 chu kì liên tiếp thì:
- |ZA – ZB| = 8 nếu nguyên tố thuộc chu kì nhỏ
- |ZA – ZB| = 18 nếu có nguyên tố thuộc chu kì lớn
– Nếu 2 nguyên tố thuộc 2 chu kì liên tiếp và ở 2 nhóm A liên tiếp thì:
- |ZA – ZB| = 7 hoặc 9 (nếu có nguyên tố thuộc chu kì nhỏ)
- |ZA – ZB| = 17 hoặc 19 (nếu cả 2 nguyên tố đều thuộc chu kì lớn)