Khí Clo – Tính chất hóa học của clo, hóa học phổ thông

1. Tính chất vật lí
– Clo là chất khí, màu vàng lục, mùi xốc, nặng hơn không khí.

– Khí clo tan vừa phải trong nước tạo thành nước clo có màu vàng nhạt. Clo tan nhiều trong các dung môi hữu cơ.
– Khí clo độc.
2. Tính chất hóa học
– Do lớp e ngoài cùng đã có 7e nên clo là phi kim điển hình, dễ nhận thêm 1e thể hiện tính oxi hóa mạnh.
– Trong các hợp chất, clo thường có mức oxi hóa -1; trong hợp chất với F hoặc O, clo còn có mức oxi hóa +1; +3; +5; +7. Vì vậy trong một số phản ứng, clo còn có tính khử.
a. Tác dụng với kim loại
– Clo phản ứng với hầu hết các kim loại trừ Au và Pt → muối halogenua. Các phản ứng thường xảy ra ở nhiệt độ cao. Muối thu được thường ứng với mức hóa trị cao của kim loại.
2M + nCl2 → 2MCln
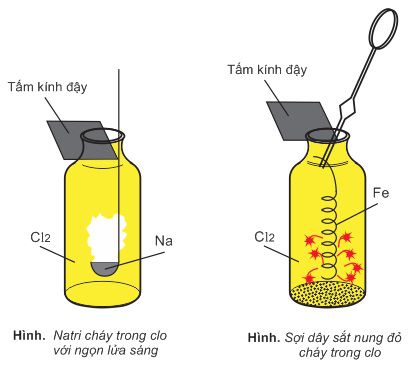
b. Phản ứng với hiđro tạo thành hiđro clorua
H2 + Cl2 → 2HCl (ánh sáng)
c. Tác dụng với nước
– Cl2 có phản ứng thuận nghịch với nước:
H2O + Cl2 ↔ HCl + HClO (axit clohiđric và axit hipoclorơ)
Khi để lâu hoặc bị chiếu sáng thì HClO bị phân hủy: HClO HCl + O
Vì HClO có chứa ion ClO– có tính oxi hóa mạnh nên có thể dùng nước Clo để tẩy màu hoặc sát trùng.
d. Phản ứng với dung dịch kiềm
– Nếu dung dịch kiềm loãng nguội:
Cl2 + 2NaOH → NaCl + NaClO + H2O
(nước Javen)
2Cl2 + 2Ca(OH)2 dung dịch → CaCl2 + Ca(ClO)2 + 2H2O
Cl2 + Ca(OH)2 bột → CaOCl2 + H2O
(clorua vôi)
– Nếu dung dịch kiềm đặc nóng:
3Cl2 + 6KOH → 5KCl + KClO3 + 3H2O (1000C)
e. Clo đẩy brom và iot khỏi dung dịch muối bromua và iotua
Cl2 + 2NaBr → 2NaCl + Br2
Cl2 + 2KI → 2KCl + I2
g. Một số phản ứng khác
2FeCl2 + Cl2 → 2FeCl3
3Cl2 + 2NH3 → N2 + 6HCl
4Cl2 + H2S + 4H2O → 8HCl + H2SO4
3. Điều chế
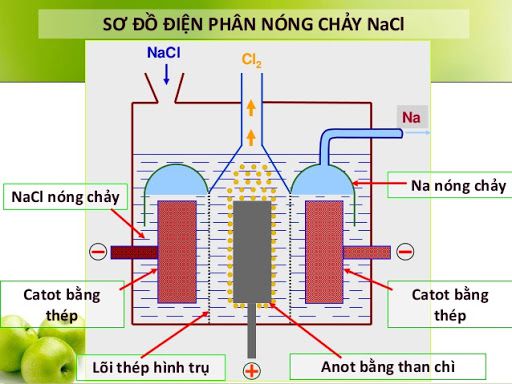
a. Điện phân muối halogenua
– Điện phân nóng chảy:
2NaCl → 2Na + Cl2
– Điện phân dung dịch muối halogenua của kim loại kiềm có màng ngăn:
2NaCl + 2H2O → H2 + 2NaOH + Cl2
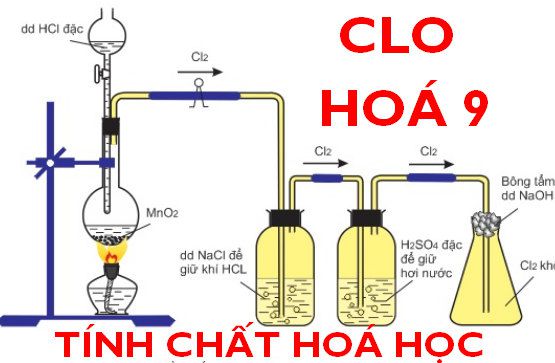
b. Cho HX tác dụng với các chất oxi hóa mạnh (thường gặp: MnO2, KMnO4, K2Cr2O7, KClO3).
MnO2 + 4HCl → MnCl2 + Cl2 + 2H2O
2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 5Cl2 + 6H2O
K2Cr2O7 + 14HCl → 2KCl + 2CrCl3 + 3Cl2 + 7H2O
KClO3 + 6HCl → 3H2O + KCl + 3Cl2
4. Ứng dụng
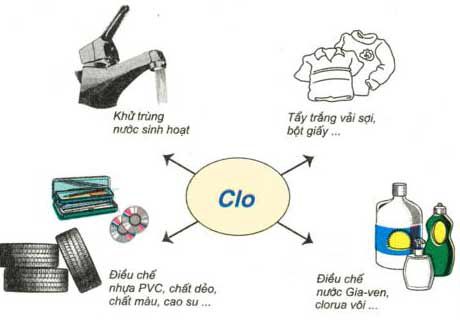
– Dùng làm chất sát trùng trong hệ thống cung cấp nước sạch.
– Tẩy trắng vải, sợi, giấy…
– Là nguyên liệu để sản xuất nhiều hợp chất hữu cơ và vô cơ.
5. Trạng thái tự nhiên
Chỉ tồn tại ở dạng hợp chất:
Clo chủ yếu tồn tại ở dạng muối clorua, quan trọng nhất là NaCl. NaCl có trong nước biển và đại dương. NaCl được tìm thấy ở trạng thái rắn gọi là muoosimor. KCl cũng khá phổ biến, nó có trong khoáng vật cacnalit KCl.MgCl2.6H2O và xinvinit NaCl.KCl.