Lưu huỳnh trioxit – Hợp chất của lưu huỳnh
Lưu huỳnh trioxit (còn gọi là anhyđrit sulfuric, sulfur trioxit, sulfane) là một hợp chất hóa học với công thức SO3. Là chất lỏng không màu, tan vô hạn trong nước và axit sulfuric. Lưu huỳnh trioxide khô tuyệt đối không ăn mòn kim loại. Ở thể khí, đây là một chất gây ô nhiễm nghiêm trọng và là tác nhân chính trong các trận mưa axit. SO3 được sản xuất đại trà để dùng trong điều chế axit sunfuric

| Công thức phân tử | SO3 |
| Khối lượng phân tử | 80,06 g mol−1 |
| Số CAS | [7446-11-9] |
| Mật độ | 1,92 g cm−3 |
| Độ hòa tan (Nước) | Thủy phân |
| Điểm nóng chảy | 16,9 °C, 62,4 °F |
| Điểm sôi | 45 °C, 113 °F |
| Điểm tới hạn | 218,3 °C tại 8,47 MPa |
Cấu tạo và liên kết Lưu huỳnh trioxit
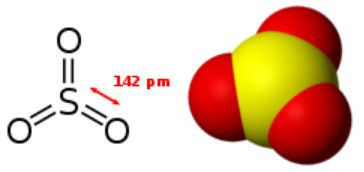
Khí SO3 có cấu tạo phân tử tam diện phẳng và đối xứng, như được dự đoán trước bởi lý thuyết VSEPR.
Nguyên tử lưu huỳnh có chỉ số oxi hóa là +6, điện tích là 0 và bao quanh bởi 6 cặp electron.
Các phản ứng hóa học Lưu huỳnh trioxit
SO3 là chất anhydrit của H2SO4. Do đó, các phản ứng sau sẽ xảy ra:
SO3 + H2O -> H2SO4 (phản ứng tỏa nhiều nhiệt )
Lưu huỳnh trioxit cũng phản ứng với lưu huỳnh diclorua để tạo ra chất thuốc thử hữu dụng thionyl clorua.
SO3 + SCl2 -> SOCl2 + SO2
Ở nhiệt độ cao Lưu huỳnh trioxit bị nhiệt phân khi có chất xúc tác là oxit vanadi (V).
SO3 -> SO2 + O2
Điều chế Lưu huỳnh trioxit
Trong công nghiệp người ta sản suất lưu huỳnh trioxit bằng cách oxi hóa lưu huỳnh đioxit bởi oxi với sự có mặt của chất xúc tác là oxit vanadi (V)
Phản ứng xảy ra như sau
2SO2 + O2 → 2SO3 (với xúc tác V2O5, ở nhiệt độ cao khoảng 450 – 500 °C)
SO2 cũng có thể phản ứng với O2 ở nhiệt độ thấp hơn với xúc tác là NO2 để tạo SO3
2SO2 + O2 → 2SO3 (nhiệt độ cao, chất xúc tác NO2)
Quá trình phản ứng diễn ra như sau:
Ban đầu NO2 phản ứng với SO2 tạo SO3: SO2 + NO2 → SO3
Sau đó O2 lại phản ứng tiếp với NO tạo NO2. Quá trình trên lại được lặp lại