HỢP CHẤT HALOGEN VÀ TÍNH CHẤT

Hợp chất Halogen: Hiđrohalogenua (HX)
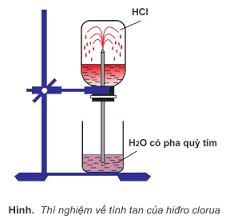
– Tất cả đều là chất khí, tan nhiều trong nước, điện li hoàn toàn (trừ HF) tạo thành dung dịch axit mạnh.
– Thứ tự tính axit và tính khử tăng dần: HF < HCl < HBr < HI
– Tính axit mạnh của HCl, HBr và HI:
+ Làm quỳ tím chuyển thành màu đỏ.
+ Tác dụng với kim loại đứng trước H → muối trong đó kim loại có hóa trị thấp + H2.
Fe + 2HCl → FeCl2 + H2
+ Tác dụng với oxit kim loại → muối (trong đó kim loại giữ nguyên hóa trị) + H2O.
Fe3O4 + 8HCl → 4H2O + FeCl2 + 2FeCl3
HI + muối sắt (III) → muối sắt (II) + I2
+ Tác dụng với bazơ → muối (trong đó kim loại giữ nguyên hóa trị) + H2O.
Fe(OH)2 + 2HCl → FeCl2 + 2H2O
+ Tác dụng với muối → muối mới + axit mới
Na2CO3 + 2HBr → 2NaBr + H2O + CO2
– Tính khử thể hiện khi tác dụng với các chất oxi hóa mạnh (xem phần điều chế clo).
– HF có tính chất riêng là ăn mòn thủy tinh:
4HF + SiO2 → SiF4 + 2H2O
– Điều chế:
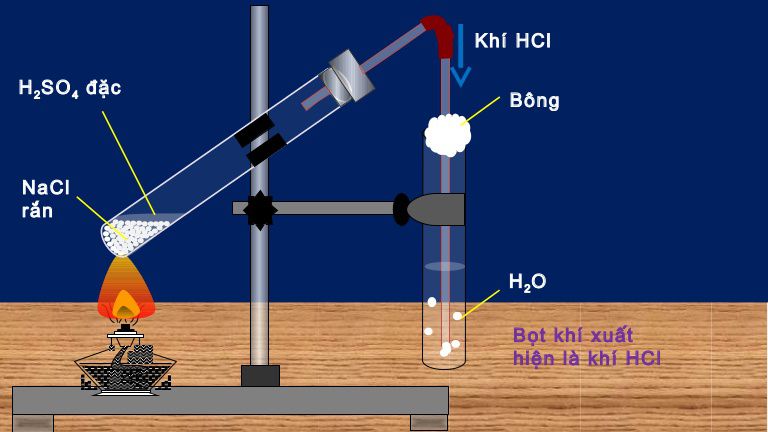
+ Phương pháp sunfat (trong phòng thí nghiệm): (HBr và HI không dùng được cách này do có tính khử)
NaCl rắn + H2SO4 đặc → NaHSO4 + HCl (< 2500C)
2NaCl rắn + H2SO4 đặc → Na2SO4 + 2HCl (> 4000C)
+ Phương pháp tổng hợp (trong công nghiệp):
H2 + Cl2 → 2HCl (ánh sáng, nhiệt độ cao)
HF được điều chế nhờ phản ứng:
CaF2 + H2SO4 → CaSO4 + 2HF ở 2500C
Hợp chất Halogen: Muối halogenua
– Muối của axit halogen hidric được gọi là muối halogenua.
– Các muối clorua hầu hết đều tan trừ PbCl2 và AgCl, CuCl, Hg2Cl2. Tính tan của muối bromua và iođua tương tự clorua.
– Để nhận biết ion X– có thể dùng thuốc thử là dung dịch AgNO3:
+ AgF tan trong dung dịch.
+ AgCl kết tủa trắng (AgCl tan trong dung dịch amoniac do tạo phức với NH3).

+ AgBr kết tủa vàng nhạt (không tan trong NH3 dư)
+ AgI kết tủa vàng đậm (không tan trong NH3 dư)

– Các muối AgX kết tủa thường dễ bị phân hủy bởi nhiệt hoặc ánh sáng: 2AgX → 2Ag + X2
Hợp chất Halogen: HClO (axit hipoclorơ)
– Là axit rất yếu, yếu hơn cả axit cacbonic:
CO2 + H2O + KClO → KHCO3 + HClO
– Kém bền, chỉ tồn tại được trong dung dịch nước:
HClO → HCl + O
– HClO và muối của nó đều có tính oxi hóa rất mạnh.
Hợp chất Halogen: HClO3 (axit cloric) và muối clorat
a. HClO3
– Là axit khá mạnh, tan nhiều trong nước, có tính oxi hóa mạnh.
– Điều chế bằng cách nhiệt phân HClO:
3HClO → HClO3 + 2HCl.
b. Muối kali clorat
– Muối KClO3 được dùng làm thuốc nổ, diêm tiêu:
6P + 5KClO3 → 3P2O5 + 5KCl
– Nhiệt phân KClO3:
+ Nếu có xúc tác MnO2:
2KClO3 → 2KCl + 3O2
+ Nếu không có xúc tác MnO2:
4KClO3 → 3KClO4 + KCl
Hợp chất Halogen: HClO4 (axit pecloric)
– Là axit rất mạnh, tan nhiều trong nước. Phản ứng loại nước từ HClO4 có mặt P2O5 → Cl2O7.
2HClO4 → Cl2O7 + H2O
– Điều chế từ KClO4
KClO4 + H2SO4 → HClO4 + KHSO4
Chú ý: Từ HClO đến HClO2,HClO3, HClO4: Tính axit và tính bền tăng, tính oxi hóa giảm.