I. Tính chất vật lí của Axit Cacboxylic

– Axit có nhiệt độ sôi cao hơn Ancol có khối lượng phân tử tương đương vì phân tử axit tạo được 2 liên kết H và liên kết H giữa các phân tử axit bền hơn liên kết H giữa các phân tử Ancol.
– Từ C1 đến C3 tan vô hạn trong nước do có khả năng tạo liên kết H liên phân tử với nước.
– C4 đến C5 ít tan trong nước; từ C6 trở lên không tan do gốc R cồng kềnh và có tính kị nước.
Axit Carboxylic – Định nghĩa, phân loại, danh pháp.
1. Axit carboxylic là gì?
– Định nghĩa: Axit cacboxylic là hợp chất hữu cơ mà phân tử có nhóm – COOH liên kết với gốc hiđrocacbon, với H hoặc với nhau.
– Công thức cấu tạo của axit carboxylic:
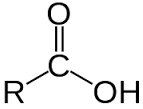
– Nhóm -COOH là nhóm chức của cacboxylic
2. Phân loại axit carboxylic
– Dựa vào đặc điểm của gốc hidrocacbon và số nhóm cacboxyl trong phân tử mà các axit được chia thành:
• Axit no đơn chức: CnH2n+1COOH (n ≥ 0) hoặc CmH2mO2 (m ≥ 1).
• Axit hữu cơ không no, mạch hở, đơn chức trong gốc hiđrocacbon có 1 liên kết đôi: CnH2n-1COOH (n ≥ 2) hoặc CmH2m-2O2 (m ≥ 3).
• Axit hữu cơ no, 2 chức, mạch hở: CnH2n(COOH)2 (n ≥ 0).
3. Cách gọi tên Cacboxylic – Danh pháp
a) Tên thay thế
Tên thay thế = Tên hiđrocacbon tương ứng + oic
b) Tên thường của một số axit thường gặp
| Công thức | Tên gọi |
| HCOOH | Axit fomic |
| CH3COOH | Axit axetic |
| CH3CH2COOH | Axit propionic |
| CH3CH2CH2COOH | Axit butiric |
| CH2=CH-COOH | Axit acrylic |
| CH2=C(CH3)-COOH | Axit metacrylic |
| (COOH)2 | Axit oxalic |
| C6H5COOH | Axit benzoic |
| HOOC(CH2)4COOH | Axit ađipic |
| C15H31COOH | Axit pamitic |
| C17H35COOH | Axit stearic |
| C17H33COOH | Axit oleic |
| C17H31COOH | Axit linoleic |
II. Cách Điều chế, nhận biết và ứng dụng của Axit cacboxylic
1. Điều chế Axit cacboxylic
a) Oxi hóa anđehit
R(CHO)x + x/2O2 → R(COOH)x (xúc tác Mn2+, t0)
b) Thủy phân este trong môi trường axit
Ry(COO)xyR’x + xyH2O ↔ yR(COOH)x + xR’(OH)y
c) Thủy phân dẫn xuất 1,1,1 – trihalogen
RCCl3 + 3NaOH → RCOOH + 3NaCl + H2O (H2O)
d) Riêng CH3COOH
n-C4H10 + 5/2O2 \[\overset{Mn^{2+},t^{o}}{\rightarrow}\] 2CH3COOH + H2O
C2H5OH + O2 \[\overset{\text{Men giấm}}{\rightarrow}\] CH3COOH + H2O
e) Một số phản ứng khác
C6H5-CH3 → C6H5COOK → C6H5COOH
R-X → R-CN → R-COOH
CH3OH + CO → CH3COOH
2. Cách nhận biết Axit cacboxylic
– Làm quỳ tím chuyển thành màu đỏ; tác dụng với kim loại giải phóng H2; tác dụng với muối cacbonat hoặc hiđrocacbonat giải phóng khí CO2.
– Axit không no làm mất màu dung dịch Br2, dung dịch thuốc tím.
– HCOOH có phản ứng tương tự andehit: tạo được kết tủa trắng với AgNO3/NH3,…
3. Ứng dụng của Axit cacboxylic
a) Axit axetic
– Axit axetic được dùng để điều chế những chất có ứng dụng quan trọng như: axit cloaxetic (dùng tổng hợp chất diệt cỏ 2,4-D; 2,4,5-T … ), muối axetat của nhôm, crom, sắt (dùng làm chất cầm màu khi nhuộm vải, sợi), một số este (làm dược liệu, hương liệu, dung môi,…), xenlulozơ axetat (chế tơ axetat),…
b) Các axit cacboxylic khác
– Các axit béo như axit panmitic C15H31COOH, axit stearic C17H35COOH,… được dùng để chế xà phòng. Axit benzoic được dùng trong tổng hợp phẩm nhuộm, nông dược,… Axit salixylic dùng để chế thuốc cảm, thuốc xoa bóp, giảm đau,…
– Các axit đicacboxylic (như axit ađipic, axit phtalic,…) được dùng trong sản xuất poliamit, polieste để chế tơ sợi tổng hợp.