Hợp chất của sắt bao gồm: sắt (II) oxit; sắt (II) hidroxit; Muối Fe2+; Oxit và hiđroxit sắt (III)

1. Hợp chất của sắt (II)
a. Hợp chất sắt (II) oxit (FeO)

– FeO vừa có tính oxi hóa, vừa có tính khử.
– FeO có tính khử, tác dụng với chất oxi hoá như axit H2SO4 đặc nóng hoặc HNO3
2FeO + 4H2SO4(đặc) \[\overset{t^{o}}{\rightarrow}\] Fe2(SO4)3 + SO2 ↑ + 4H2O
3FeO + 10HNO3 (loãng) \[\overset{t^{o}}{\rightarrow}\] 3Fe(NO3)3 + NO ↑ + 5H2O
FeO + 4HNO3 (đặc) \[\overset{t^{o}}{\rightarrow}\] Fe(NO3)3 + NO2 + 2H2O
– FeO có tính oxi hóa, tác dụng với chất khử như H2, CO:
FeO + H2 \[\overset{t^{o}}{\rightarrow}\] Fe + H2O
FeO + CO \[\overset{t^{o}}{\rightarrow}\] Fe + CO2 ↑
FeO là oxit bazơ, tác dụng với dung dịch axit, FeO là chất rắn, màu đen, không tan trong nước.
– Điều chế FeO:
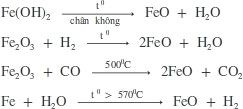
b. Hợp chất của sắt (II) hidroxit (Fe(OH)2)
– Fe(OH)2 là chất kết tủa màu xanh.
– Fe(OH)2 có tính khử, tác dụng với chất oxi hóa như không khí, H2SO4 đặc, HNO3…
4Fe(OH)2 + O2 + 2H2O→ 4Fe(OH)3 ↓
(màu trắng xanh) (màu nâu đỏ)
2Fe(OH)2 + 4H2SO4 đặc \[\overset{t^{o}}{\rightarrow}\] Fe2(SO4)3 + SO2 ↑ + 6H2O
3Fe(OH)2 + 10HNO3(loãng) → 3Fe(NO3)3 + NO ↑ + 8H2O
Fe(OH)2 + 4HNO3(đặc) → Fe(NO3)3 + NO2 ↑ + 3H2O
– Fe(OH)2 có tính bazơ, tác dụng với dung dịch axit:
Fe(OH)2 + H2SO4 (loãng) → FeSO4 + 2H2O
– Nhiệt phân Fe(OH)2 : Fe(OH)2 \[\xrightarrow[t^{o}]{Chân không}\] FeO + H2O
Nếu nhiệt phân trong không khí:
2Fe(OH)2 + 1/2O2 \[\overset{t^{o}}{\rightarrow}\] Fe2O3 + 2H2O
c. Hợp chất muối sắt (II)
(1) Muối Fe2+
(FeCl2, Fe(NO3)2, FeSO4) có tính khử và tính oxi hoá
– Tính khử:
3FeSO4 + 3/2Cl2 → Fe2(SO4)3 + FeCl3
4FeSO4 + O2 + 2H2O → 4Fe(OH)SO4
2FeCl2 + Cl2 → 2FeCl3
(màu lục nhạt) (màu nâu vàng)
6FeSO4 + K2Cr2O7 + 7H2SO4 → 3Fe2(SO4)3 + Cr2(SO4)3 + K2SO4 + 7H2O
10FeSO4 + 2KMnO4 +8H2SO4 → 5Fe2(SO4)3 + 2MnSO4 + K2SO4 + 8H2O
Fe(NO3)2 + AgNO3 → Fe(NO3)3 + Ag↓
– Tính oxi hoá : 2Al + 3Fe2+ → 2Al3+ + 3Fe
(2) FeCƠ3
– Nhiệt phân FeCO3: FeCƠ3 \[\xrightarrow[t^{o}]{Chân không}\] FeO + CO2
Nếu nhiệt phân trong không khí: 4FeCƠ3 + O2 \[\overset{t^{o}}{\rightarrow}\] 2Fe2O3 + 4CO2
– Tác dụng với dung dịch axit:
• FeCƠ3 tác dụng với dung dịch axit HCl và H2SO4 loãng cho khí CO2 ↑ và muối Fe2+
FeCƠ3 + 2HCl → FeCl2 + CO2 ↑ + H2O
FeCƠ3 + H2SO4 (loãng) → FeSO4 + CO2 ↑ + H2O
• FeCƠ3 tác dụng với dung dịch H2SO4 đặc, HNO3 cho hỗn hợp khí SO2, CO2, hoặc NO2, CO2, hoặc NO, CO2 và muối Fe3+.
2FeCƠ3 + 4H2SO4 (đặc) → Fe2(SO4)3 + 2CO2 ↑ + SO2 ↑ + 4H2O
3FeCƠ3 + 10HNO3(loãng) → Fe(NO3)3 + 3CO2 ↑ + NO ↑ + 5H2O
FeCƠ3 + 4HNO3(đặc) → Fe(NO3)3 + CO2 ↑ + NO2 ↑ + 2H2O
2. Hợp chất của sắt (III)
Lưu ý: Fe3O4 là hợp chất của FeO và Fe2O3
Fe3O4 + 8HCl → FeCl2 + 2FeCl3 + 4H2O
Fe3O4 + 4H2SO4 (loãng) → FeSO4 + Fe2(SO4)3 + 4H2O
2Fe3O4 + 10H2SO4 (đặc) → 3Fe2(SO4)3 + SO2 ↑ + 10H2O
Fe3O4 + 10HNO3(đặc) → 3Fe(NO3)3 + NO2 ↑ + 5H2O
3Fe3O4 + 28HNO3(loãng) → 9Fe(NO3)3 + NO ↑ + 14H2O
a. Tính chất hóa học của hợp chất sắt (III)
(1) Hợp chất sắt (III) có tính oxi hóa
Khi tác dụng với chất khử, các hợp chất sắt (III) sẽ bị khử. thành các hợp chất sắt (II) hoặc sắt tự do
Fe3+ + 1e → Fe2+
Fe3+ + 3e → Fe
Một số thí dụ minh họa cho tính oxi hóa của hợp chất sắt (III):
– Hợp chất sắt (III) oxi hóa nhiều kim loại thành ion dương
2FeCl3 + Fe → 3FeCl2
2FeCl3 + Cu → 2FeCl2 + CuCl2
– Hợp chất sắt (III) oxi hóa một số hợp chất có tính khử:
2FeCl3 + 2KI → 2FeCl2 + 2KCl + I2
2FeCl3 + H2S → 2FeCl2 + S ↓ + 2HCl
Fe2(SO4)3 + SO2 + 2H2O → FeSO4 + 2H2SO4
![]()
(2) Oxit và hiđroxit sắt (III) có tính bazơ
Sắt (III) oxit và sắt (III) hidroxit có tính bazơ. Chúng tác dụng với axit tạo thành muối sắt (III).
b. Điều chế một số hợp chất của sắt (III)
– Điều chế Fe2O3: 2Fe(OH)3 → Fe2O3 + 3H2O
2FeSO4 \[\overset{t^{o}}{\rightarrow}\] Fe2O3 + SO2 ↑ + SO3
– Điều chế Fe(OH)3: FeCl3 + 3NaOH → Fe(OH)3 ↓ + 3NaCl
– Muối sắt (III) có thể điều chế trực tiếp từ sắt với các chất oxi hóa như Cl2, HNO3, H2SO4 đặc nóng
hoặc các hợp chất sắt (III) với axit:
Fe2O3 + 6HCl → 2FeCl3 + 3H2O
2Fe(OH)3 + 3H2SO4 → 3Fe2(SO4)3 + 6H2O
c. Ứng dụng của hợp chất của sắt (III)
Muối FeCl3 được dùng làm chất xúc tác trong một số phản ứng hữu cơ
Muối Fe2(SO4)3 có trong phèn sắt amoni (NH4)Fe(SO4)2.12H2O được dùng làm trong nước. Fe2O3 được dùng để pha chế sơn chống gỉ.