Lưu huỳnh (hay Sulfur, đọc như “Xun-phua”) là nguyên tố hóa học trong bảng tuần hoàn hóa học có ký hiệu S và số nguyên tử 16. Nó là một phi kim phổ biến, không mùi, không vị, nhiều hóa trị. Lưu huỳnh, trong dạng gốc của nó là chất rắn kết tinh màu vàng chanh. Trong tự nhiên, nó có thể tìm thấy ở dạng đơn chất hay trong các khoáng chất sulfua và sulfat. Nó là một nguyên tố thiết yếu cho sự sống và được tìm thấy trong hai axit amin. Sử dụng thương mại của nó chủ yếu trong các phân bón nhưng cũng được dùng rộng rãi trong thuốc súng, diêm, thuốc trừ sâu và thuốc diệt nấm.

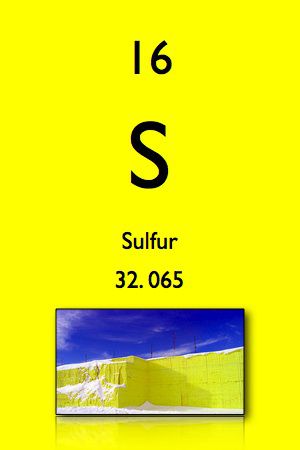
1. Lưu huỳnh
- Biểu tượng: S
- Khối lượng nguyên tử: 32,065 u
- Điểm nóng chảy: 115,2 °C
- Số nguyên tử: 16
- Cấu hình điện tử: [Ne] 3s²3p⁴
- Độ âm điện: 2,58
a. Tính chất vật lí của lưu huỳnh
Là chất bột màu vàng, không tan trong nước. S có 6e ở lớp ngoài cùng → dễ nhận 2e thể hiện tính oxi hóa mạnh. Tính oxi hóa của S yếu hơn so với O.
b. Tính chất hóa học của lưu huỳnh
Các mức oxi hóa có thể có của S: -2, 0, +4, +6. Ngoài tính oxi hóa, S còn có tính khử.
* Tính oxi hóa
– Tác dụng với hiđro:
H2 + S → H2S (3500C)
– Tác dụng với kim loại
+ S tác dụng với nhiều kim loại → muối sunfua (trong đó kim loại thường chỉ đạt đến hóa trị thấp).
+ Hầu hết các phản ứng xảy ra ở nhiệt độ cao.
2Na + S → Na2S
Hg + S → HgS
(phản ứng xảy ra ở ngay nhiệt độ thường nên thường dùng S khử độc Hg)
– Muối sunfua được chia thành 3 loại:
+ Loại 1. Tan trong nước gồm Na2S, K2S, CaS và BaS, (NH4)2S.
+ Loại 2. Không tan trong nước nhưng tan trong axit mạnh gồm FeS, ZnS…
+ Loại 3. Không tan trong nước và không tan trong axit gồm CuS, PbS, HgS, Ag2S…
Chú ý: Một số muối sunfua có màu đặc trưng: CuS, PbS, Ag2S (màu đen); MnS (màu hồng); CdS (màu vàng) → thường được dùng để nhận biết gốc sunfua.
* Tính khử
– Tác dụng với oxi:
S + O2 → SO2 (t0)
– Tác dụng với các chất có tính oxi hóa mạnh
S + 2H2SO4 đặc → 3SO2 + 2H2O (t0)
S + 4HNO3 đặc → 2H2O + 4NO2 + SO2 (t0)
c. Ứng dụng lưu huỳnh
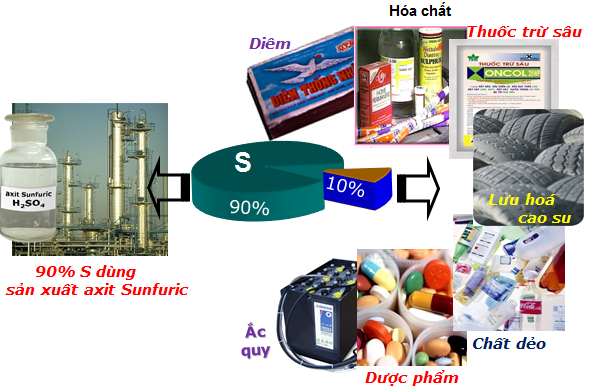
Là nguyên liệu cho nhiều ngành công nghiệp:
– 90% dùng để sản xuất H2SO4.
– 10% để lưu hóa cao su, chế tạo diêm, sản xuất chất tẩy trắng bột giấy, chất dẻo ebonit, dược phẩm, phẩm nhuộm, chất trừ sâu và chất diệt nấm nông nghiệp…