Phản ứng hóa học của đơn chất Halogen

Phản ứng hóa học của đơn chất Halogen: Tác dụng với kim loại
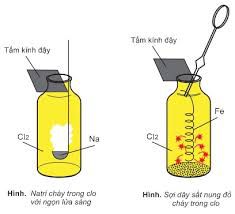
– Các halogen phản ứng với hầu hết các kim loại trừ Au và Pt (riêng F2 phản ứng được với tất cả các kim loại) → muối halogenua. Các phản ứng thường xảy ra ở nhiệt độ cao.
2M + nX2 → 2MXn
Muối thu được thường ứng với mức hóa trị cao nhất của kim loại. Riêng phản ứng của Fe với I2 chỉ tạo sản phẩm là FeI2.
Phản ứng hóa học của đơn chất Halogen: Phản ứng với hiđro tạo thành hiđro halogenua
H2 + X2 → 2HX
– Các halogen tham gia phản ứng cộng H2 với điều kiện khác nhau:
+ F2: phản ứng được ngay cả trong bóng tối.
+ Cl2: phản ứng khi được chiếu sáng.
+ Br2: phản ứng xảy ra khi được đun nóng ở nhiệt độ cao.
+ I2: phản ứng có tính thuận nghịch và phải được đun nóng.
– Điều kiện phản ứng với H2 phức tạp dần khi đi từ F2 đến I2 nên phản ứng với H2 có thể chứng minh tính oxi hóa trong nhóm halogen giảm dần từ F2 đến I2.
Phản ứng hóa học của đơn chất Halogen: Tác dụng với nước
– F2 tác dụng mãnh liệt với nước:
2H2O + 2F2 → 4HF + O2
→ Phản ứng chứng minh F2 có tính oxi hóa mạnh hơn của O2.
– Br2 và Cl2 có phản ứng thuận nghịch với nước:
H2O + X2 ↔ HX + HXO (axit halogen hiđric và axit hipohalogenơ)
H2O + Cl2 ↔ HCl + HClO
Khi để lâu hoặc bị chiếu sáng thì HClO bị phân hủy: HClO HCl + O. Vì HClO có chứa ion ClO– có tính oxi hóa mạnh nên có thể dùng nước Clo để tẩy màu hoặc sát trùng.
– I2 không phản ứng với nước.
Phản ứng hóa học của đơn chất Halogen: Phản ứng với dung dịch kiềm
– Nếu dung dịch kiềm loãng nguội:
X2 + 2NaOH → NaX + NaXO + H2O
Cl2 + 2NaOH → NaCl + NaClO + H2O
(nước Javen)
2Cl2 + 2Ca(OH)2 dung dịch → CaCl2 + Ca(ClO)2 + 2H2O
Cl2 + Ca(OH)2 bột → CaOCl2 + H2O
(clorua vôi)
Riêng F2:
2F2 + 2NaOH → 2NaF + H2O + OF2
– Nếu dung dịch kiềm đặc nóng:
3X2 + 6KOH → 5KX + KXO3 + 3H2O
3Cl2 + 6KOH → 5KCl + KClO3 + 3H2O (1000C)
Phản ứng hóa học của đơn chất Halogen: Tác dụng với dung dịch muối halogenua của halogen có tính oxi hóa yếu hơn
(F2 không có phản ứng này)
X2 + 2NaX’ → 2NaX + X’2
(trong đó X’ là halogen có tính oxi hóa yếu hơn tính oxi hóa của halogen X).
Các cặp oxi hóa – khử của halogen được xếp theo chiều giảm dần tính khử của các ion X–: I2/2I– > Br2/2Br– > Cl2/2Cl–
Trong nước:
5Cl2 + 6H2O + Br2 → 10HCl + 2HBrO3
Phản ứng hóa học của đơn chất Halogen: Một số phản ứng khác
2FeCl2 + Cl2 → 2FeCl3
3Cl2 + 2NH3 → N2 + 6HCl
4Cl2 + H2S + 4H2O → 8HCl + H2SO4
Br2 + SO2 + 2H2O → 2HBr + H2SO4
I2 kết hợp với hồ tinh bột → hợp chất màu xanh tím.
Chú ý
Trong phản ứng với kim loại và với H2, với dung dung dịch muối của các halogen yếu hơn, halogen là chất oxi hóa. Còn trong phản ứng với nước và dung dịch kiềm, các halogen vừa là chất khử, vừa là chất oxi hóa.